
【题目】某温度时,发生反应2HI(g)![]() H2(g)+I2(g),向三个体积相等的恒容密闭容器A、B、C中,分别加入①2mol HI;②3mol HI;③1mol H2与1mo1I2,分别达平衡时,以下关系正确的是
H2(g)+I2(g),向三个体积相等的恒容密闭容器A、B、C中,分别加入①2mol HI;②3mol HI;③1mol H2与1mo1I2,分别达平衡时,以下关系正确的是
A. 平衡时,各容器的压强:②=①=③
B. 平衡时,I2的浓度:②>①=③
C. 平衡时,I2的体积分数:②>①=③
D. 从反应开始到达平衡的时间:①>②=③
【答案】B
【解析】
根据等效平衡原理,若1mol H2与1molI2完全转化为HI,则HI为2mol,所以①和③是完全相同的等效平衡,所以二者的浓度,百分含量,压强转,化率等都一样;②与①相比增大了HI的量,该反应为反应前后气体体积不变的反应,增大HI的量,达到平衡时新平衡与原平衡相同,所以各物质的百分含量不变,但是浓度增大。
A项、由于恒容密闭容器,②中初始的量大,所以压强最大,故A错误;
B下、由于恒容密闭容器,②中初始的量大,所以②中I2的浓度最大,①和③是完全相同的等效平衡,二者I2的浓度相同,所以平衡时,I2的浓度:②>①=③,故B正确;
C项、①②③都是等效平衡,所以三者中I2的体积分数相同,故C错误;
D项、由于②中初始的量大,反应浓度大,反应速率快,所以到达平衡所用时间最短,所以②<③,故D错误。
故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某学习小组查阅资料加。大多数硝酸盐不稳定。受热易分解,分解产物与金属活动顺序有关)了探究硝酸铁分解产物。他们进行如下探究:
(一)探究气体产物
[提出假设]
他们对气体产物提出如下猜想:
猜想1:气体为NO2
猜想2:气体为NO和O2
猜想3:气体为NO和NO2
清想4:气体为NO2和O2
猜想5:气体为NO
(1)他们经过讨论,认为猜想2不成立。理由是_______;根据氧化还原反应原理,不成立的猜想还有__________
[查阅资料]
①几种气体熔点。沸点如下:
气体 | NO | NO2 | O2 |
熔点/℃ | -163.6 | -11.2 | |
沸点/℃ | -151 | 21.1 | -183 |
②2NO2(g) ![]() N2O4(g)(无色) ΔH<0
N2O4(g)(无色) ΔH<0
[设计实验]
加热装置省略(冰盐冷却剂温度约为-5℃)

取一定量无水硝酸铁粉术进行实验,实验结果: A中U型管收集到少量液体物质;B中排水法收集一部分气体
(2)本实验的橡胶寨、导管接口处都用锡箔纸包裹,其目的是___________
(3)实验完毕,取出U型管,打开塞子。观察到有棕色气体产生,则U型管内的气体是_____
向U型管加入_____能吸收该物质。避免污染环境。
(4)检验B瓶收集气体为氧气的操作方法是__________
(二)探究固体成分
分析固体中铁元素价态,可能有种情况:①+2价②+3价③+2价和+3价。
为了探究固体中铁元素价态。甲、乙同学设计如下方案:
步骤 | 现象 | |
甲 | 取少量样品于试管,加入适量稀硫酸使固体完全溶解,再滴加酸性高锰酸钾溶液 | 溶液无明显颜色变化 |
乙 | 取少量样品于试管,加入稀盐酸使固体完全溶解,滴加KSCN溶液 | 溶液变红色 |
(5)上述实验,不能确定固体成分的实验是______(填“甲”或“乙”);根据上迷实验结论。写出硝酸铁分解反应的化学方程式______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6mol X气体和0.4mol Y气体混合于2L容器中,发生反应:3X(g)+Y(g)== nZ(g)+2W(g),5min末已生成0.2mol W,若测知以Z浓度变化来表示的平均速率为0.03mol·L﹣1·min﹣1,计算:
(1)n的值为____;
(2)前5min内用X表示的反应速率_____;
(3)5min末Y的浓度_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Be在周期表中位于Al的左上方,则下列有关Be的说法中错误的是
A.单质Be与酸或碱反应都能放出氢气B.Be(OH)2为两性氢氧化物
C.Be的氧化物的化学式为Be2O3D.BeCl2晶体属于分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道:“染色”馒头中添加柠檬黄铬酸铅(PbCrO4)会使人体致癌,已被明文禁用。已知铬元素(Cr)化合价为+6价,则铅元素(Pb)的化合价为( )
A.+1B.+2C.+3D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.1 mol/L、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
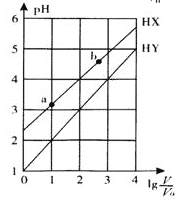
A.HX、HY都是弱酸,且HX的酸性比HY的弱
B.常温下,由水电离出的c(H+)·c(OH -):a<b
C.相同温度下,电离常数K( HX):a>b
D.![]() =3,若同时微热两种溶液(不考虑HX 、HY和H2O的挥发),则
=3,若同时微热两种溶液(不考虑HX 、HY和H2O的挥发),则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下的六份溶液:①0.01molL﹣1 CH3COOH溶液;②0.01molL﹣1 HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01molL﹣1 CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01molL﹣1 HCl溶液与pH=12的NaOH溶液等体积混合所得溶液.
(1)其中水的电离程度最大的是__________(填序号,下同),水的电离程度相同的是_____________________.
(2)若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②_____③(填“>”“<”或“=“).
(3)将六份溶液同等稀释10倍后,溶液的pH:①_____②,③_____④,⑤_____⑥(填“>”“<”或“=“).
(4)将①④混合,若有c(CH3COO﹣)>c(H+),则混合溶液可能呈___________(填序号).
A.酸性 B.碱性 C.中性.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式为 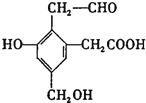 ,取Na、NaOH、NaHCO3分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、NaHCO3三种物质的物质的量为
,取Na、NaOH、NaHCO3分别与等物质的量的该物质恰好反应(反应时可加热煮沸),则Na、NaOH、NaHCO3三种物质的物质的量为
A. 2:2 :1 B. 1:1:1 C. 3:2:1 D. 3:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,气体A为无色有毒气体,气体B为黄绿色气体,请根据下图完成填空。

(1)A是________,E是________;
(2)A与B在水溶液中反应的离子方程式是:______;
(3)分别将气体A与B通入如下装置,待一段时间后,分别加热甲、乙两支试管。

①试管甲中的实验现象为_______________,原因是_________________________;
②试管乙中的实验现象为_________________________,原因是___________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com