
 2HI (g)达平衡的是
2HI (g)达平衡的是| A.单位时间内消耗amol H2,同时消耗 2amol HI |
| B.容器内的总压强不随时间变化 |
| C.容器内H2、I2不再减少,HI不再增加 |
| D.单位时间内每生成amol HI,同时a NA个HI分子分解 |
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案科目:高中化学 来源:不详 题型:填空题
 Fe(s)+CO2(g) △H>0
Fe(s)+CO2(g) △H>0| A.其它条件不变,增加高炉的高度 | B.调节还原时的炉温 |
| C.增加原料中焦炭与赤铁矿的比例 | D.将生成的铁水 及时移出 及时移出 |
 Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2g的FeO,同时通入4.48L的CO气体(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为 ▲ 。(精确到0.1%)
Fe(s)+CO2(g),平衡常数K=0.4。今在一密闭容器中,加入7.2g的FeO,同时通入4.48L的CO气体(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为 ▲ 。(精确到0.1%)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g);△H=mkJ·mol-1
2SO3(g);△H=mkJ·mol-1


 NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,
NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下, 的电离平衡常数Kb=1.7×10—5 mol·L—1)
的电离平衡常数Kb=1.7×10—5 mol·L—1)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g) + H2(g)反应,一定条件下达到平衡,①增大水蒸汽浓度,平衡向 反应方向移动(填“正”、“逆”或“不”下同),CO的浓度将 。(填“增大”、“减小”或“不变”下同)
CO(g) + H2(g)反应,一定条件下达到平衡,①增大水蒸汽浓度,平衡向 反应方向移动(填“正”、“逆”或“不”下同),CO的浓度将 。(填“增大”、“减小”或“不变”下同) N2O4(g) 当活塞迅速向外拉时,平衡向 反应方向移动,气体的颜色先变_____(“浅”、“深”或“不变”下同),后变______;最终和最初相比,_____更深(填“前”或“后”)。
N2O4(g) 当活塞迅速向外拉时,平衡向 反应方向移动,气体的颜色先变_____(“浅”、“深”或“不变”下同),后变______;最终和最初相比,_____更深(填“前”或“后”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 | O2 | S | Se | Te |
| ΔH(kJ·mol-1) | -242 | -20 | 81 | |
 (填“一定增大”、“一定减小”或“不能确定”)。
(填“一定增大”、“一定减小”或“不能确定”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 FeO(s) + CO(g),其温度与平衡常数K的关系如下表:
FeO(s) + CO(g),其温度与平衡常数K的关系如下表:| T(K) | 938 | 1173 |
| K | 1.47 | 2.15 |
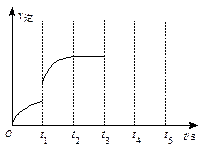
 画出t3~ t5时间段的v逆变化曲线。
画出t3~ t5时间段的v逆变化曲线。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是 | A.容器内压强不随时间变化 | B.容器内密度不随时间变化 |
| C.容器内X、Y、Z的浓度之比为1︰2︰2 | |
| D.单位时间消耗0.1 mol X同时生成0.2 mol Z |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.C(s) + CO2(g) 2CO(g) (正反应为吸热反应) 2CO(g) (正反应为吸热反应) |
B.3O2(g) 2O3(g)(正反应为吸热反应) 2O3(g)(正反应为吸热反应) |
C.CO(g) + NO2(g) CO2(g)+NO(g) (正反应为放热反应) CO2(g)+NO(g) (正反应为放热反应) |
D.N2 (g) + 3H2(g) 2NH3(g) (正反应为放热反应) 2NH3(g) (正反应为放热反应) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com