
【题目】五种短周期元素在元素周期表中的位置如图所示,已知:E元素原子的最外层电子数是次外层的2倍。下列说法不正确的是
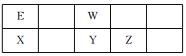
A. X有多种氢化物 B. 简单阴离子的半径:Y>Z
C. 气态氢化物的稳定性:W>Y>Z D. Y的氢化物与Z单质能发生化学反应
科目:高中化学 来源: 题型:
【题目】氮氧化铝(AlON)属原子晶体,是一种超强透明材料,可以由反应Al2O3+C+N2![]() 2AlON+CO合成,下列有关说法正确的是( )
2AlON+CO合成,下列有关说法正确的是( )
A. 氮氧化铝中氮的化合价是-3
B. 反应中氧化产物和还原产物的物质的量之比是1∶2
C. 反应中每生成5.7 g AlON同时生成1.12 L CO
D. AlON和CO的化学键类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液与30.0g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15g/cm3的混合溶液.计算:
(1)混合后溶液的质量分数。
(2)混合后溶液的物质的量浓度。
(3)在1 000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个密闭容器中分别充入CO、CH4、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是( )
A. p(CO)>p(CH4)>p(O2) B. p(O2)>p(CO)>p(CH4)
C. p(CH4)>p(O2)>p(CO) D. p(CH4)>p(CO)>p(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生将一氯丙烷和NaOH溶液共热煮沸几分钟后,冷却,滴入AgNO3溶液,结果未见到白色沉淀生成,其主要原因是( )
A.加热时间太短B.不应冷却后再滴入AgNO3溶液
C.加AgNO3溶液后未加稀HNO3D.加AgNO3溶液前未用稀HNO3酸化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化得CO和H2,在催化剂存在条件下进一步合成甲醇(反应I),并同时发生反 应II.
I.CO(g)+2H2(g) ![]() CH3OH(g) △H1 = -81 kJ mol-1
CH3OH(g) △H1 = -81 kJ mol-1
II. CO(g)+H2(g) ![]() C(s)+H2O (g) △H2
C(s)+H2O (g) △H2
已知:①2C(s)+O2(g)=2CO(g) △H3 =-221 kJ mol-1
② H2O(g)=H2O(1) △H4 =-44.0 kJ mol-1
③H2的标准燃烧热为285. 8 kJ mol-1
④反应过程中催化剂对选择性会产生影响,甲醇选择性是指转化的CO中生成甲醇的百分比。
请回答:
(1)反应 II 中△H2 =______ kJ mol-1
(2)为减弱副反应II的发生,下列采取的措施合理的是_________。
A.反应前加入少量的水蒸气 B.增压
C.降低反应温度 D.使用合适催化剂,平衡前提高甲醇的选择性
(3)在常压下,CO和H2的起始加入量为10 mol、14 mol,容器体积为10 L.选用Cu/NiO催化剂,升高温度在450℃时测得甲醇的选择性为80%,CO的转化率与温度的关系如图所示,则此温度下反应I的平衡常数K=_______,并说明CO的转化率随温度升高先增大后减小的原因:____________。

(4)350℃时甲醇的选择性为90%,其他条件不变,画出350℃时甲醇的物质的量随时间的变化曲线。_________________
(5)甲醇燃料电池由甲醇电极、氧电极和质子交换膜构成,写出负极的电极反应式:_________。实验证明CO在酸性介质中可电解产生甲醇,写出阴极的电极反应式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,相同体积的甲、乙两种气体的质量比是17∶14。若乙气体是CO,则甲气体可能是( )
A. H2S B. HCl C. NH3 D. Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关,下列说法正确的是( )
A. SO2有漂白性,可广泛用于食品增白工业
B. 浓硫酸不能与Al反应,故可用铝槽车运送浓硫酸
C. 14C可用于文物年代鉴定,14C与12C互为同位素
D. 从海水中提取的所有物质都须通过化学反应才能实现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com