
| A、二者在水中的溶解度不同,碳酸氢钠的溶解度大于碳酸钠的溶解度 |
| B、二者热稳定性不同,碳酸钠的热稳定性小于碳酸氢钠的热稳定性 |
| C、二者都能与盐酸反应放出二氧化碳气体,反应快慢相同 |
| D、二者在一定的条件下可以相互转化 |
| ||
| ||
| ||


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
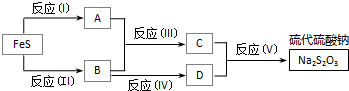
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 实验仪器及装置 | 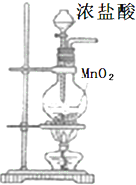 |  NaOH溶液 NaOH溶液 | 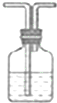 浓硫酸 浓硫酸 | 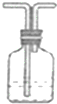 饱和食盐水 饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
| B、I2+SO2+2H2O═H2SO4+2HI |
| C、H2O2+2H++SO42-═SO2↑+O2↑+2H2O |
| D、2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、33.6 L |
| B、11.2 L |
| C、22.4 L |
| D、44.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 强电解质 | NaCl | H2SO4 | CaCO3 | HNO3 |
| 弱电解质 | HF | BaSO4 | HClO | CH3COOH |
| 非电解质 | Cl2 | CS2 | C2H5OH | H2S |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有①③ | B、①②④⑤ |
| C、①②③④ | D、①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com