
工业上用粉碎的煤矸石(主要含Al2O3、SiO2及铁的氧化物)制备净水剂 BAC〔Al2(OH)nCl6-n〕的流程如下:
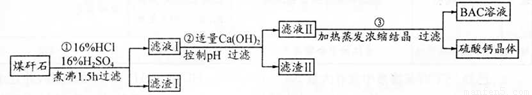
(1)粉碎煤矸石的目的是______;滤渣I的主要成分是______ (填化学式)。
(2)步骤①在煮沸的过程中,溶液逐渐由无色变为绿色,此时溶液中有色离子为______ (填 化学式);随后溶液又变为棕黄色,相关离子反应方程式为______;
步骤①的煮沸装置上方需安装一长导管,长导管的作用是____________。
(3)步骤②中加入适量的Ca(OH)2并控制pH,其目的:一是生成BAC;二是___________ ;巳 知BAC的分散质粒子大小在1 nm〜100 nm之间,由此区别滤液I与BAC两种液体的物理方法是______;若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,写出该反应的离子方程式______。
(4)若0.1 mol AlCl3在某温度下溶于蒸馏水,当有5℅水解生成Al(OH)3溶液时,吸收热量a kJ。写出该过程的热化学方程式____________。
(15分)(1)增大反应物接触面积,加快溶解速率(提高Al3+的浸出率)(2分)SiO2(1分)
(2)Fe2+(1分)4Fe2++O2+4H+=4Fe3++2H2O(2分)冷凝、回流(1分)
(3)除Fe3+(2分)用一束光照射液体,观察是否产生丁达尔现象(或丁达尔效应)(2分)
Al3++4OH-=AlO2-+2H2O(2分)
(4)AlCl3(aq)+3H2O(l) 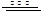 Al(OH)3(aq)+3HCl(aq)
△H=+200akJ/mol(2分)
Al(OH)3(aq)+3HCl(aq)
△H=+200akJ/mol(2分)
【解析】
试题分析: (1)将煤矸石粉碎可增大反应物接触面积,加快溶解速率。二氧化硅不溶于盐酸、硫酸,滤渣I为二氧化硅。
(2)呈绿色的离子是Fe2+,随后Fe2+酸性条件下被空气中氧气氧化为Fe3+。长导管的作用是冷凝、回流。
(3)由分散质粒子直径可知BAC为胶体,区分溶液和胶体可根据胶体能产生丁达尔效应、溶液不能产生丁达尔效应。加氢氧化钙的目的是调节pH使Fe3+沉淀,若氢氧化钙过量,则发生Al3++4OH-=AlO2-+2H2O,使BAC产率偏低。
(4)反应0.005molAlCl3吸热akJ,所以反应1molAlCl3时吸热200akJ。
考点: 化工生产流程图的分析 影响化学反应速率的因素 离子方程式 物质的鉴别 热化学方程式


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com