
族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ |
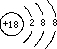 ,故答案为:Ar;
,故答案为:Ar;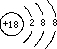 ;
; ,
, ;
;

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
| 实 验 事 实 | 结 论 | |
| A | 常温下1mol?L-1醋酸的酸性比0.1mol?L-1醋酸强 | 弱酸的电离度随浓度的增大而增大 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaBr溶液中通入Cl2时,溶液变橙黄色 | 非金属性:Cl>Br |
| D | 盐酸酸性比氢硫酸(H2S的水溶液)强 | 非金属性:Cl>S |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.有关说法正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.有关说法正确的是( )| A、a、b、c三点溶液的pH:a>b>c |
| B、若使C点的c(CH3COO-)增大,溶液的pH也增大,可加入适量的CH3COONa固体 |
| C、a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a>b>c |
| D、用湿润的pH试纸测量c处溶液的pH值,比实际pH值偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol/L NaCl溶液含有NA个Na+ |
| B、标准状况下,22.4L H2O中含有NA个H2O分子 |
| C、常温下,22g CO2含有NA个氧原子 |
| D、2mol铝与足量稀盐酸反应生成3NA个H2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量二氧化碳通入水玻璃中:CO2+SiO32-+H2O═CO32-+H2SiO3↓ |
| B、钠投入水中:Na+H2O═Na++OH-+H2↑ |
| C、AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
| D、氯气通入水中:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

| 改变的反应条件 | 反应速率改变的结果 |
| 降低反应体系的温度 | |
| 将容器的体积改为1L | |
| 使用催化剂 | |
| 保持容器体积不变,充入一定量氦气,增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在铜与硫的反应中,1mol铜失去的电子数为NA |
| B、标准状况下,11.2LSO3所含硫原子数为0.5NA |
| C、由2H和18O所组成的水11g,其中所含的中子数为4NA |
| D、1molCl2与足量的水反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 溶液 | 加入物质 | 答案序号 |
| 氯化铝溶液 | 加入过量氨水 | |
| 饱和石灰水 | 通入过量CO2气体 | |
| 含少量HCl的氯化铝溶液 | 加入过量的氨水 | |
| 含少量氯化氢的氯化铝溶液 | 逐滴加入NaOH溶液 | |
| MgCl2、AlCl3的混合液 | 逐滴加入NaOH溶液至过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com