
【题目】硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)下列物质不属于硅酸盐的是____。
A.陶瓷 B.玻璃 C.水泥 D.生石灰
(2)SiO2是玻璃的主要成分之一,SiO2与氢氧化钠溶液反应的化学方程式为____________________,工艺师常用______(填物质名称)来雕刻玻璃。
(3)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作______。Na2SiO3可通过SiO2与纯碱混合高温熔融反应制得,高温熔融纯碱时下列坩埚可选用的是___。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.瓷坩埚 D.铁坩埚
(4)工业上常利用反应2C+SiO2![]() Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是___(填化学式,下同),氧化剂是____
Si+2CO↑制备硅单质,该反应中所含元素化合价升高的物质是___(填化学式,下同),氧化剂是____
【答案】D SiO2+2NaOH![]() Na2SiO3+H2O 氢氟酸 防火剂 D C SiO2
Na2SiO3+H2O 氢氟酸 防火剂 D C SiO2
【解析】
本题考查硅及其化合物的性质,(1)A、陶瓷属于传统的无机物非金属材料,属于硅酸盐,故A错误;B、玻璃成分中含有Na2SiO3、CaSiO3、SiO2等,Na2SiO3、CaSiO3属于硅酸盐,故B错误;C、水泥属于硅酸盐,故C错误;D、生石灰是CaO,不含Si元素,因此生石灰不属于硅酸盐,故D正确;(2)SiO2属于酸性氧化物,因此与NaOH反应的化学方程式为SiO2+2NaOH=Na2SiO3+H2O;因为SiO2与氢氟酸发生反应,因此工艺师常用氢氟酸雕刻玻璃;(3)用Na2SiO3水溶液浸泡过的棉花不易燃烧,说明Na2SiO3可用作防火剂;A、普通玻璃中含有SiO2,熔融纯碱时能与SiO2发生反应,因此不能用普通玻璃坩埚熔融纯碱,故A错误;B、石英是SiO2,能与纯碱反应,因此不能用石英玻璃坩埚熔融纯碱,故B错误;C、瓷坩埚中含有SiO2,因此熔融纯碱时不能用瓷坩埚,故C错误;D、铁单质不与纯碱反应,因此可以用铁坩埚熔融纯碱,故D正确;(4)根据化学反应方程式,化合价升高的是C,氧化剂是化合价降低物质,即氧化剂为SiO2。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】原子个数和价电子数都相等的微粒叫等电子体,下列微粒组是等电子体的是( )
A. N2O4和NO2 B. NaCl和MgCl2
C. NO和O2 D. SO![]() 和PO
和PO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分子式为C7H8的芳香烃在镍的催化下与足量氢气加成后生成环烷烃,请写出该环烷烃的一氯代物的结构简式:______、______、_______、_______、_______。
(2)烷烃C8H18的一种同分异构体只生成一种一氯代物,试写出这种异构体的结构简式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25 C 时,Ksp[Zn(OH)2]= 1.0×10-18, Ka(HCOOH)= 1.0×10-4。该温度下,下列说法错误的是
A. HCOO-的水解平衡常数为 1.0×10-10
B. 向 Zn(OH)2 悬浊液中加少量 HCOOH,溶液中 c(Zn2+)增大
C. Zn(OH)2溶于水形成的饱和溶液中,c(Zn2+)>1.0×10-6 mol/L
D. Zn(OH)2(s) +2HCOOH(aq)![]() Zn2+(aq) +2HCOO-(aq) +2H2O(l)的平衡常数 K= 100
Zn2+(aq) +2HCOO-(aq) +2H2O(l)的平衡常数 K= 100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、 B、 C、 D、 E、 F 为前四周期元素且原子序数依次增大,其中基态 A 原子的电子分布在 3 个能级,且每个能级所含的电子数相同; C 的原子核外最外层有 6 个运动状态不同的电子; D 是短周期元素中电负性最小的元素; E 的最高价氧化物的水化物酸性最强; 基态 F 原子核外最外层只有一个电子, 其余能层均充满电子。 G 元素与 D 元素同主族,且相差 3 个周期。
(1)元素 A、 B、 C 的第一电离能由小到大的是____________________(用元素符号表示)。
(2)E的最高价含氧酸中 E 原子的杂化方式为_____________。 基态 E 原子中,核外电子占据最高能级的电子云轮廓形状为____________________________。
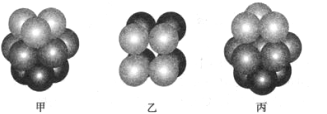
(3)F原子的外围电子排布式为_______________________, F 单质晶体中原子的堆积方式是下图中的_______(填写“甲”、 “乙”或“丙”) ,该晶体的空间利用率为_____________。(保留两位有效数字)
(4)已知元素 A、B形成的(AB)2分子中所有原子都满足 8电子稳定结构,则其分子中 σ键与 π键数目之比为__________。
(5)通常情况下, D 单质的熔沸点比 G 单质高,原因是_________________________。
(6)已知 DE 晶体的晶胞如下图所示:
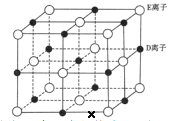
若将 DE 晶胞中的所有 E 离子去掉,并将 D 离子全部换为 A 原子,再在其中的 4 个“小立方体”中心各放置一个A 原子,且这 4 个“小立方体”不相邻。位于“小立方体”中的 A 原子与最近的 4 个 A 原子以单键相连,由此表示 A的一种晶体的晶胞(已知 A—A 键的键长为a cm, NA表示阿伏加德罗常数),则该晶胞中含有_________个 A 原子,该晶体的密度是______________g·cm-3(列式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此回答下列问题:
(1)I、II、III、IV四步操作采取的分离方法是___________________。
(2)根据上述框图反应关系,写出下列B、C、E所含物质的化学式
沉淀固体B________________;C______________________;E_______________
(3)写出①、④四个反应方程式(是离子反应的写离子方程式)
①____________________________ ④__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应:2SO2(g)+ O2(g)![]() 2SO3 △H<0。得到如表中的两组数据,下列说法不正确的是
2SO3 △H<0。得到如表中的两组数据,下列说法不正确的是
实验编号 | 温度/℃ | 平衡常数/mol-1·L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
A. T1、T2的关系:T1 > T2
B. x= 1.6,y=0.2 ,t<6
C. K1、K2的关系:K2>K1
D. 实验1在前6min的反应速率υ(SO2)=0.2 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下 列离子方程式书写正确的是( )
A. 氯气通入水中:Cl2+H2O = 2H++Cl-+ClO-
B. 铁和稀硫酸反应:2Fe+6H+ = 2 Fe3++3H2↑
C. 碳酸钙与醋酸反应:CaCO3+2H+ = Ca2++CO2↑+H2O
D. 氢氧化铝和氢氧化钠溶液反应:Al(OH)3+OH- = AlO2-+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com