
| A. | 碳水化合物都符合通式Cn(H2O)m | |
| B. | 符合通式Cn(H2O)m的物质都是糖类 | |
| C. | 糖类物质都有甜味 | |
| D. | 糖类是人类维持生命的六大营养素之一 |
分析 A.糖曾被称为“碳水化合物”,糖类大多数满足这个通式,但也有不满足的,如鼠李糖C6H12O5;
B.乙酸(C2H402)也符合通式Cm(H2O)n;
C.糖类不一定具有甜味;
D.人体的六大营养物质是:水、无机盐、蛋白质、脂肪、糖类和维生素.
解答 解:A.鼠李糖(C6H12O5)的组成不符合通式Cm(H2O)n,故A错误;
B.乙酸(C2H402)也符合通式Cm(H2O)n,但乙酸不是糖,故B错误;
C.糖类不一定具有甜味,如纤雏素是多糖,但没有甜味,故C错误;
D.糖类是人类维持生命的营养素之一,故D正确.
故选D.
点评 本题主要考查了糖的组成和性质,为高频考点,难度不大,注意基础知识的掌握.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | 第三周期非金属元素的含氧酸的酸性从左到右依次增强 | |
| B. | HF、HCl、HBr、HI的热稳定性和还原性从上到下依次减弱 | |
| C. | 在ⅥA族元素的氢化物(H2R)中,沸点最高的一定是无毒的 | |
| D. | 同一主族的元素,原子半径越大,其单质的熔点也一定越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③②④ | B. | ④①②③ | C. | ④①③② | D. | ①④③② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 →CH≡C-CH═CH2
→CH≡C-CH═CH2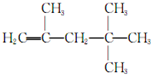 ,它是由不饱和烃乙的两个分子在一定条件下自身加成而得到的.在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长的碳链仍为5个碳原子,丙是甲的同分异构体.则乙的结构简式是
,它是由不饱和烃乙的两个分子在一定条件下自身加成而得到的.在此反应中除生成甲外,同时还得到另一种产量更多的有机物丙,其最长的碳链仍为5个碳原子,丙是甲的同分异构体.则乙的结构简式是 ,丙的结构简式是
,丙的结构简式是 .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表中同周期元素从左到右,元素的电负性逐渐增大 | |
| B. | 周期表中同主族元素从上到下,元素的电负性逐渐增大 | |
| C. | 电负性越大,金属性越强 | |
| D. | 电负性越小,非金属性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的气态氢化物能使湿润的红色石蕊试纸变蓝;M和Ne原子的核外电子数相差1;N与X相邻;X的氧化物是制造光导纤维的主要原料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大.
W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的气态氢化物能使湿润的红色石蕊试纸变蓝;M和Ne原子的核外电子数相差1;N与X相邻;X的氧化物是制造光导纤维的主要原料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com