
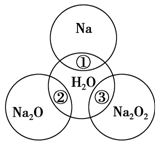
 如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g,忽略溶液中溶剂的变化.完成下列题目.
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g,忽略溶液中溶剂的变化.完成下列题目.分析 (1)根据过氧化钠和水反应的方程式计算生成氧气的物质的量;
(2)离子方程式要遵循“原子守恒和电荷守恒等”规律;
(3)过氧化钠中的阴离子是过氧根离子不是氧离子,根据化学式判断阴阳离子个数之比;
(4)根据固体的物质的量计算溶液中溶质的质量、溶液的质量,根据质量分数公式判断质量分数相对大小.
解答 解:(1)反应③:2Na2O2+2H2O=4NaOH+O2↑,
2mol 1mol
0.1mol 0.05mol
根据方程式知,最多产生0.05molO2,故答案为:0.05mol;
(2)Na+2H2O═Na++2OH-+H2↑中电荷不守恒,反应①正确的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)过氧化钠中阴离子是O2 2-,所以阴阳离子数目之比为1:2,故答案为:1:2;
(4)钠、氧化钠、过氧化钠和水反应的方程式分别如下:
Na+H2O=NaOH+$\frac{1}{2}$H2↑,溶液增加的质量=m(Na)-m(H2)=2.3g-0.1g=2.2g;
Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;
Na2O2+H2O=2NaOH+$\frac{1}{2}$O2↑,溶液增加的质量=m(Na2O2)-m(O2)=m(Na2O)=6.2g
所以溶液增加的质量大小顺序为:钠<氧化钠=过氧化钠,
根据钠原子守恒知,0.1mol的钠、氧化钠、过氧化钠、溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol,通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠、分别溶于水所得溶液的质量分数分别为:$\frac{4g}{100g+2.2g}$、$\frac{8g}{100g+6.2g}$、$\frac{8g}{100g+6.2g}$,所以①、②、③充分反应后所得溶液的质量分数从大到小:③=②>①,故答案为:③=②>①.
点评 本题考查了钠及其化合物的性质,易错选项是(3),注意过氧化钠中阴离子是过氧根离子不是氧离子,此为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4LH2O含有的分子数为NA | |
| B. | 在常温和常压下,22gCO2含有的分子数为0.5NA | |
| C. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| D. | 在同温、同压下,相同体积的任何气体,所含分子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量的NaHCO3逐滴加入Ba(OH)2溶液中:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| B. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O→CO32-+2C6H5OH | |
| D. | 向100 mL 3mol•L-1FeBr2溶液中通入标准状况下 3.36 LCl2:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
| SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2$\frac{\underline{\;100℃\;}}{\;}$SO2↑+Cl2↑ |
| H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com