
| ① | ② | ③ | ④ |
| 0.1mol/L 盐酸 | pH=3 盐酸 | 0.1mol/L 氨水 | pH=11 氨水 |
| A. | 由水电离出的c(H+):①>③ | |
| B. | ③稀释到原来的100倍后,pH与④相同 | |
| C. | ①与③混合,若溶液pH=7,则V(盐酸)>V(氨水) | |
| D. | ②与④混合,若溶液显碱性,则所得溶液中离子浓度可能为:c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
分析 A.溶液中氢离子或氢氧根离子的浓度越大,对水的抑制程度越大;
B.0.1mol/L氨水中氢氧根离子浓度小于0.1mol/L,溶液的pH<13,稀释到原来的100倍后,促进氨水电离;
C.①与③混合,若溶液pH=7,c(H+)=c(OH-),结合电荷守恒分析;
D.②与④混合,若溶液显碱性,则为氨水与氯化铵的混合溶液.
解答 解:A.0.1mol/LHCl溶液中,由水电离出的c(H+)为10-13mol/L,0.1mol/L 氨水,c(OH-)<0.1mol/L,则由水电离出的c(H+)大于10-13mol/L,所以由水电离出的c(H+)为①<③,故A错误;
B.0.1mol/L氨水中氢氧根离子浓度小于0.1mol/L,溶液的pH<13,稀释到原来的100倍后,促进氨水电离,pH变化小于2个单位,所以③的pH可能与④不同,故B错误;
C.①与③混合,若溶液pH=7,c(H+)=c(OH-),由电荷守恒可知c(Cl-)=c(NH4+),氨水和HCl恰好反应生成氯化铵,氯化铵溶液显酸性,若溶液显中性,所以氨水要过量,则V(盐酸)<V(氨水),故C错误;
D.②与④混合,若溶液显碱性,则为氨水与氯化铵的混合溶液,氨水的浓度大于氯化铵的浓度,则溶液中可能存在c(OH-)>c(Cl-),结合电荷守恒可知溶液中离子浓度可能为c(NH4+)>c(OH-)>c(Cl-)>c(H+),故D正确;
故选D.
点评 本题考查酸碱混合pH的判断及溶液酸碱性的分析,选项C为解答的难点,注意酸碱混合时pH与浓度的关系、电离与水解的关系等即可解答,题目难度较大


科目:高中化学 来源: 题型:选择题
| A. | ②③④⑦⑧ | B. | ②③④⑥⑦ | C. | ③④⑥⑦⑧ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

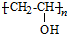 、CH3CH2CH2CHO.
、CH3CH2CH2CHO.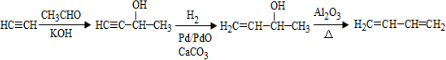 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 给试管中的铜与浓硫酸加热,发现试管底部有白色固体并夹杂有少量黑色物质,此白色固体为硫酸铜,黑色固体为氧化铜 | |
| B. | SO2通入足量的Fe(NO3)3稀溶液中,溶液有棕黄色变为浅绿色,但立即又变成棕黄色,说明氧化性:HNO3>稀硫酸>Fe3+ | |
| C. | 配制一定物质的量浓度溶液时发现浓度偏低,可能由于配制溶液所用的容量瓶事先未干燥 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
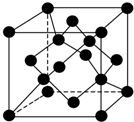 自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:
自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物.按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
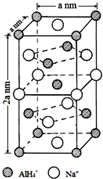 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15,.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15,.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
. (标明配位键).
(标明配位键).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物中含有0.05molFe元素 | |
| B. | 该硝酸溶液中溶质的质量分数是63% | |
| C. | 所加入NaOH溶液的体积最少是450mL | |
| D. | 反应中HNO3被氧化,生成氧化产物NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 物质的量浓度(mol/L) | 1 | 1 | a | 1 |
| A. | 阳极生成1.5mol Cl2 | B. | a=3 | ||
| C. | 电解后溶液中c(H+)=1moL/L | D. | 阴极析出的金属是铜与铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com