
【题目】有CuO、Fe、H2、Ba(OH)2溶液、K2CO3溶液、NaOH溶液、稀硫酸七种物质,在常温下两种物质两两间能发生反应最多有
A.4个 B.5个 C.6个 D.7个
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为l.0L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g)分别达到平衡。下列说法正确的是
CH3OH(g)分别达到平衡。下列说法正确的是
容器 | 温度(K) | 起始浓度(mol/L) | CH3OH平衡浓度(mol/L) | ||
H2 | CO | CH3OH | |||
① | 400 | 0.20 | 0.10 | 0 | 0.08 |
② | 400 | 0.40 | 0.20 | 0 | X |
③ | 500 | 0 | 0 | 0.10 | 0.025 |
A. 该反应的正反应是吸热反应
B. X=0.16
C. 平衡时,容器②中H2的体积分数比容器①的大
D. 400K时若再向容器①中充入0.10molH2、0.10molCO和0.10molCH3OH,则平衡将向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有相同质量的两份NaHCO3粉末,第一份加入足量盐酸,第二份先加热使其完全分解再加足量同质量分数的盐酸,则两者所消耗的盐酸中氯化氢的质量比为( )
A.2:1
B.1:1
C.1:2
D.4:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 自然界中存在不需要活化能推动的反应
B. 催化剂同时改变正逆反应速率
C. 活化分子的每次碰撞都能发生反应
D. 活化能的作用在于使反应物活化,从而启动反应或改变反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地下水受到硝酸盐污染已成为世界范围内一个相当普遍的环境问题。用零价铁去除水体中的硝酸盐(NO3-)是地下水修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。

作负极的物质是___________;正极的电极反应式是_____________。
(2)将足量铁粉投入水体中,测定NO3-去除率和pH,结果如下:

在pH =4.5的水体中,NO3-的去除率低的原因是_____________。
(3)为提高pH =4.5的水体中NO3-的去除率,某课题组在初始pH =4.5的水体中分别投入①Fe2+、②Fe、③Fe和Fe2+做对比实验结果如图:

此实验可得出的结论是____,Fe2+的作用可能是_________。(2)中NO3-去除率和铁的最终物质形态不同的原因______________。
(4)地下水呈中性,在此条件下,要提高NO3-的去除速率,可采取的措施有_______。(写出一条)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化铜(II)甲基咪唑配合物是一种制备有机玻璃的催化剂,其合成方法如下:
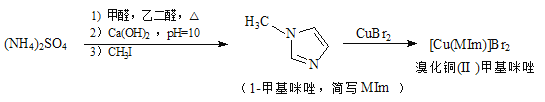
(1)铜元素位于周期表中第_____族,写出基态Cu2+的电子排布式_______。
(2)与NH4+互为等电子体的阴离子为_______。
(3)SO42-中心原子的杂化方式为_________。
(4)Mlm中含σ键与π数目之比为__________。
(5)一种铜的溴化物晶胞结构如下图所示。
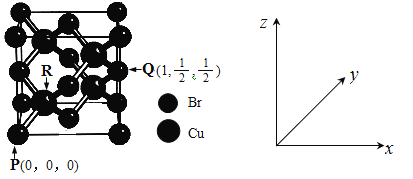
由图中P点和Q点的原子坐标参数,可确定R点的原子坐标参数为______。

(6)Cu晶体的堆积方式如图所示,设Cu原子半径为a,晶体中Cu原子的配位数为____,晶体的空间利用率为__________。(列式计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是
A. 将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同
B. 盛有相同浓度双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快
C. 将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快
D. 升高温度,H2O2的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com