
����Ŀ���� 4 mol A ����� 2 mol B ������ 2 L �Ķ��������л�ϲ���һ�������·������·�Ӧ 2A��g����B��g��![]() 2C��g�� ��H<0 ���� 2 s���룩���� C ��Ũ��Ϊ 0. 6 mol��L-1 ���������м���˵����
2C��g�� ��H<0 ���� 2 s���룩���� C ��Ũ��Ϊ 0. 6 mol��L-1 ���������м���˵����
�� ������ A ��ʾ�ķ�Ӧ��ƽ������Ϊ 0.3 mol��L-1s-1
�� �ﵽƽ��״̬ʱ�������¶ȣ���û�ѧƽ�������ƶ���ͬʱ��ѧƽ�ⳣ��KҲ��С
�� 2 s ʱ���� A ��ת����Ϊ70��
�� �ﵽƽ��״̬ʱ������A���ʵ�����A��Bת���ʶ����
�ݵ�������Ũ������c(A)=2c(B)= c(C)ʱ���÷�Ӧ�ﵽ��ƽ��״̬
������ȷ���ǣ� ��
A. �٢� B. �٢� C. �ڢ� D. �ۢ�
���𰸡�B
��������
�������ɷ���ʽ��֪2sʱ������C��Ũ����0.6mol/L,��A���ĵ�Ũ��Ҳ��0.6mol/L.����V��A��=��C/��t="0.6mol/L.��2s=0.3mol/(" L��s).��ȷ���� �÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ���ﵽƽ��״̬ʱ�������¶ȣ���û�ѧƽ�������ƶ���ͬʱ��ѧƽ�ⳣ��KҲ��С����ȷ���� 2 s ʱ���� A ��ת����Ϊ(0.6.��2) 100����30�� .���� �� �ﵽƽ��״̬ʱ��������A���ʵ����� B��ת������ߵ�A��ת���ʽ��͡���������������Ũ������c(A)="2c(B)=" c(C)ʱ���÷�Ӧ��һ���ﵽ��ƽ��״̬������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��A��B��C��D������B2-��C+��������Ų���Ne��ͬ��Bԭ����Cԭ�ӵ�������֮�͵���Dԭ�ӵ���������Aԭ��ʧȥһ�����Ӻ���һ�����ӣ��Իش�
��1��A��B��C��D��Ԫ�ط����ֱ�Ϊ________��_______��________��________��
��2��B2-�ĵ���ʽΪ______��C+���ӵĵ���ʽΪ______��Dԭ�ӵĽṹʾ��ͼΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȩ��һ����Ҫ�����ϣ��㷺Ӧ���ڻ�ױƷ��ʳ����ϵ���ҵ��G��һ�ֳ��õ���ȩ�������к���һ����Ԫ����һ����Ԫ���ṹ��G��������ͼ;���ϳɣ�

��֪��I.A�ķ���ʽΪC7H8�����ڷ�������D�IJ���������������һ������ʯ�ͻ�����չˮƽ��
��.��ȩ����Ӧԭ����

��.ͬһ��̼ԭ�����������ǻ����ȶ�������ˮ�γ��ʻ���
��ش��������⣺
(1)F������Ϊ______________________��
(2)д����A����B�Ļ�ѧ����ʽ��______________________��
(3)��Ӧ�ٵ�����Ϊ___________����Ӧ�ڵķ�Ӧ����Ϊ___________��
(4)���о����֣�ά����C������Ϊ�ϳ�G���ʵĴ��������м���Ч�ʸߡ���Ⱦ���ٵ��ŵ㣬ά����C�Ľṹ��ʽΪ ����ά����C�����к��������ŵ�����Ϊ___________��___________��
����ά����C�����к��������ŵ�����Ϊ___________��___________��
(5)��ȩG�Ľṹ��ʽΪ___________��ͬʱ��������������G��ͬ���칹����___________��(�����������칹)�����к˴Ź�������Ϊ����壬�ҷ����֮��Ϊ1��1��2��2��2��2�Ľṹ��ʽΪ______________________��
�ٱ�����ֻ������ȡ����
�ڼ��ܷ���������Ӧ��������FeCl3��Һ������ɫ��Ӧ
(6)D��һ�ֺ�4��̼ԭ�ӵ���֧��ͬϵ��H������̼ԭ��һ����ͬһƽ���ϡ�H��Ϊԭ�Ͽ�������ȡĿǰ�����ӵڶ�λ��˳������д���úϳ�·��(�����Լ���ѡ)��______________________ ![]() ˳����
˳����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣�����������ĸ�ֱ����ijһ��ѧԪ�ء�
a | b | ||||||||||||||||
c | d | ||||||||||||||||
e | f | g | h | i | |||||||||||||
j | k | l | m | ||||||||||||||
��1������kԪ�ص�ԭ�ӽṹʾ��ͼ______________________________��
��2��д��jԪ�ص�ԭ�Ӻ�������Ų�ʽ___________________________��
��3��д��lԪ�ص�+1�������Ӻ�������Ų�ʽ___________________________��
��4��д��mԪ�ص�ԭ����Χ�����Ų�ʽ___________________________��mԪ��λ�����ڱ���___________����_________��_________����
��5��ԭ�Ӱ뾶��Сe___________d����һ�����ܴ�С��ϵ��g___________h���縺�Դ�С��ϵ��c___________d�������>���� ��<������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��A��g��+2B��g��![]() C��g��+D��g�� ��H��0��һ���¶��£�2molA��2molB��2L�ܱ������з�Ӧ��10min��ﵽƽ�⣬��ʱ����ѹǿ��Ϊԭ����4/5������������ȷ����
C��g��+D��g�� ��H��0��һ���¶��£�2molA��2molB��2L�ܱ������з�Ӧ��10min��ﵽƽ�⣬��ʱ����ѹǿ��Ϊԭ����4/5������������ȷ����
A. �ӿ�ʼ��ƽ�⣬A�ķ�Ӧ����Ϊ0.08mol��L![]() ��min
��min![]()
B. ���ŷ�Ӧ�Ľ��У����������ܶ���С
C. ���¶��£���Ӧ��ƽ�ⳣ��K=20/3
D. �ﵽƽ��ʱ��B��ת����Ϊ20��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���Ϊ1L���ܱ������У�ͨ��һ������CO��H2O����T1��ʱ�������·�Ӧ��CO (g)+H2O(g) ![]() CO2(g)+H2(g) ��H<0��CO��H2OŨ�ȱ仯��ͼ����
CO2(g)+H2(g) ��H<0��CO��H2OŨ�ȱ仯��ͼ����

��1�� 0��4 min CO��ƽ����Ӧ����v(CO)=___________mol/(L��min)��
��2����ƽ��ʱCO��ת����Ϊ____________��T1��ʱ�÷�Ӧ��ƽ�ⳣ��K=_______________��
��3��T2�棨����T1�棩ʱ������ͬ�����з���������Ӧ�������ڸ����ʵ�Ũ�ȱ仯���±���
ʱ��(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | C1 | C2 | C3 | C3 |
4 | C1 | C2 | C3 | C3 |
5 | 0.116 | 0.216 | 0.084 | C4 |
�ٱ���3��4 minʱ����Ӧv��__________v�����>������<����=������ C1___________0.08mol/L���>������<����=������
��4��5 minʱ��ƽ�����淴Ӧ�����ƶ������ܵ�ԭ����__________������ĸ����
a������ˮ���� b�������¶� ��������CO2Ũ�� d������������Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����������У�����ǿ����ʵ��ǣ�����ţ���ͬ��__________������������ʵ���________�����ڷǵ����_____________��
�ٰ��� �ڰ�ˮ ������ �ܴ��� �����ᱵ ���Ȼ��� ���Ȼ��� �������̼ ������ ������
��2�������£�ȡ0.2 mol/L HCl��Һ��0.2mol/L MOH��Һ�������ϣ���û�Ϻ���Һ��pH=5��д��MOH�ĵ��뷽��ʽ��__________________��
��3���ס�����ƿ��ˮ��Ũ�ȷֱ�Ϊ1 molL-1��0.1 molL-1����c(OH��)�� ��c(OH��)��_________10(����ڡ��������ڡ���С�ڡ�)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������![]() ����
���� ����
���� �Ⱦ�Ϊ��Ҫ���л�����ԭ�ϡ�����˵����ȷ����
�Ⱦ�Ϊ��Ҫ���л�����ԭ�ϡ�����˵����ȷ����
A. �����ơ��Ż�Ϊͬϵ��B. �����ơ��ŵ�һ�ȴ���ֱ�Ϊ2��5��3��
C. �����ơ�����ֻ����������ˮD. �����ơ��ŵ�����ԭ�Ӳ����ܴ���ͬһƽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����÷�ʴ��Һ(��FeCl2��CuCl2��FeCl3)�Ʊ�����ʴ��Һ[Cu(NH3)4Cl2��Һ��FeCl36H2O����Ҫ���裺��H2O2������ʴ��Һ���Ʊ��������Ʊ�����ʴ��Һ[CuCl2+4NH3=Cu(NH3)4Cl2]����Һ���룬�������ܽ�������Ʊ�FeCl36H2O�������й�ʵ��˵����ȷ���ǣ� ��
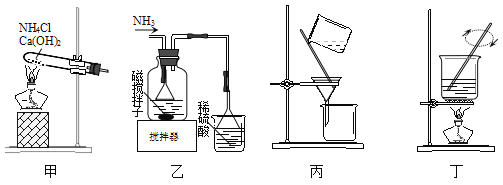
A. ��H2O2������ʴ��Һ�����ӷ���ʽΪ��2H++2Fe2++H2O2=2Fe3++2H2O
B. ��װ�ü����Ʊ�Cu(NH3)4Cl2������
C. ��װ���ҿ��Է���Cu(NH3)4Cl2��Һ��Fe(OH)3
D. ��װ�ö���FeCl3��Һ�Ʊ�FeCl36H2O��Ҫ������Ũ������ȴ�ᾧ������ϴ�ӵȲ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com