
| A. | AlCl3溶液和Al2(SO4)3溶液加热蒸干,灼烧都得到Al2O3 | |
| B. | 25℃时,Mg(OH)2固体在蒸馏水、盐酸和氯化铵溶液中的Ksp大小顺序为:盐酸>氯化铵>蒸馏水 | |
| C. | 已知25℃时,NH4F溶液显酸性,则电离常数K(NH3•H2O)<K(HF) | |
| D. | 向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合溶液中,c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
分析 A.硫酸铝水解生成氢氧化铝和硫酸,当溶液蒸干时,得到的固体是硫酸铝;
B.Ksp只与温度有关;
C.NH4F溶液显酸性,说明铵根离子的水解程度大于氟离子的水解程度,K越小水解程度越大;
D.显中性时溶液的溶质为硫酸钠,硫酸铵、一水合氨,结合电荷守恒分析.
解答 解:A.硫酸铝水解生成氢氧化铝和硫酸,硫酸难挥发,当溶液蒸干时,得到的固体是硫酸铝,氯化铝水解生成氢氧化铝和氯化氢,加热促进氯化氢挥发,从而促进氯化铝水解,将溶液蒸干得到氢氧化铝固体,灼烧时氢氧化铝分解生成氧化铝和水蒸气,所以得到的固体为Al2O3,故A错误;
B.Ksp只与温度有关,则25℃时,Mg(OH)2固体在蒸馏水、盐酸和氯化铵溶液中的Ksp均相同,故B错误;
C.NH4F溶液显酸性,说明铵根离子的水解程度大于氟离子的水解程度,K越小水解程度越大,则电离常数K(NH3•H2O)<K(HF),故C正确;
D.显中性时溶液的溶质为硫酸钠,硫酸铵、一水合氨,溶液中的电荷守恒可知,c(Na+)+c(NH4+)=2c(SO42-),而c(Na+)>c(SO42-),则c(NH4+)<(SO42-),故D错误;
故选C.
点评 本题考查了盐的水解、溶度积常数、电离常数、离子浓度大小比较等,题目涉及的知识点较多,题目难度中等,注意把握影响Ksp的因素.


科目:高中化学 来源: 题型:选择题
| A. | 两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化 | |
| B. | NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 | |
| C. | NH3分子中有一对未成键的孤电子对,它对成键电子对的排斥作用较强 | |
| D. | 氨气分子是极性分子而甲烷是非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
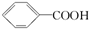 >H2CO3>
>H2CO3>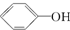 ,综合考虑反应物的转化率和原料成本等因素,将
,综合考虑反应物的转化率和原料成本等因素,将 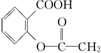 转变为
转变为 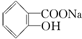 的最佳方法是( )
的最佳方法是( )| A. | 与足量的NaOH溶液共热后,再通入足量CO2 | |
| B. | 与稀H2SO4共热后,加入足量的Na2CO3溶液 | |
| C. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| D. | 与足量的NaOH溶液共热后,再加入适量H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-2119.6kJ/mol | |
| B. | C2H6(g)+$\frac{5}{2}$O2(g)═2CO(g)+3H2O(g)△H=-1559.8kJ/mol | |
| C. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(g)△H=-1559.8kJ/mol | |
| D. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1559.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 葡萄糖与蔗糖 | B. | CH2=CH-CH3和CH2=CH-CH2-CH3 | ||
| C. | 甲烷与丙烷 | D. | 丁烷与异丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
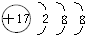 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2 过氧化钠 碱性氧化物 | B. | CO2二氧化碳 酸性氧化物 | ||
| C. | H2SO3硫酸 酸 | D. | Na2CO3 纯碱 碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,气体的体积之比等于它们的物质的量之比 | |
| B. | 同温同压下,气体的体积之比等于它们的质量之比 | |
| C. | 同温同压下,相同体积的气体的质量之比等于它们的相对分子质量之比 | |
| D. | 同温同压下,气体的密度之比等于它们的相对分子质量之比 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径A<B<C | B. | A的氢化物的稳定性大于C的氢化物 | ||
| C. | B的氧化物熔点比A的氧化物高 | D. | A与C可形成离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com