
| A. | Al | B. | Fe | C. | Cu | D. | Ag |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.3 mol/(L•min) | B. | v(N2)=0.01 mol/(L•s) | ||
| C. | v(N2)=0.2 mol/(L•min) | D. | v(H2)=0.3 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:K+、Na+、Fe2+、SO42- | |
| B. | 在碱性溶液中:Ba2+、Na+、SO42-、Cl- | |
| C. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 含大量Fe3+溶液中:K+、Cl-、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液可去除油污 | |
| B. | FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 | |
| C. | TiCl4溶于大量水加热制备TiO2 | |
| D. | 保存FeSO4溶液时加入少量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
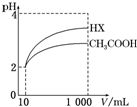 25℃时,部分物质的电离常数如表所示:
25℃时,部分物质的电离常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 不小心将少量浓硫酸沾到皮肤,立即用水冲洗 | |
| B. | 如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液 | |
| C. | 为了避免浪费,应该把实验用剩的药品放回原试剂瓶中 | |
| D. | 连接并组装成套仪器时,一般按自下而上、从左到右的顺序进行安装 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com