
【题目】下列说法正确的是( )
①Na2O、Fe2O3、Al2O3属于碱性氧化物,CO2、SiO2、NO2属于酸性氧化物
②碳酸钠、氢氧化钡、氯化铝、过氧化钠都属于离子化合物
③漂白粉、水玻璃、Fe(OH)3胶体、冰水混合物均属于混合物
④醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
⑤硅导电,食盐水导电均属于物理变化
⑥盐酸属于混合物,而液氯、冰醋酸均属于纯净物。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【答案】D
【解析】
①Na2O、Fe2O3能和酸反应生成盐和水,属于碱性氧化物;Al2O3既能和酸反应生成盐和水又能和碱反应生成盐和水,属于两性氧化物;CO2、SiO2、NO2能和碱反应生成盐和水,属于酸性氧化物,故此项错误;
②碳酸钠、氢氧化钡、过氧化钠中含有离子键,属于离子化合物,而氯化铝属于共价化合物,故此项错误;
③漂白粉的主要成分是氯化钙和次氯酸钙,属于混合物;水玻璃是硅酸钠水溶液,属于混合物;Fe(OH)3胶体是分散系,属于混合物;冰水混合物中只含有H2O,属于纯净物,故此项错误;
④醋酸是弱酸;烧碱是氢氧化钠,属于碱;纯碱是碳酸钠,属于盐;生石灰是氧化钙,属于氧化物,故此项正确;
⑤食盐水导电过程中发生了化学变化:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,故此项错误;
2NaOH+H2↑+Cl2↑,故此项错误;
⑥盐酸是HCl的水溶液,属于混合物;而液氯中只含Cl2,冰醋酸指纯醋酸,均属于纯净物,故此项正确;
故选D。


科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,加热至350 ℃左右开始分解放出氧气。过氧化钙能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。其工业制备的主要流程如下:
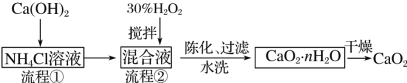
(1)搅拌的目的是______。流程②中没有采用加热措施的可能原因是______、______。流程②的化学反应方程式为________________。
(2)整个流程中,除水外还可以循环使用的物质是______。
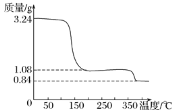
(3)取上述制得的CaO2·nH2O晶体进行热重分析,其热分解时晶体的质量随温度变化的曲线如右图。请通过计算给出过氧化钙晶体(CaO2·nH2O)的化学式(写出计算过程) __________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有0.2mol某有机物和0.5mol氧气在一密闭容器中燃烧得产物为CO2、CO、H2O(气)。产物依次通过浓硫酸时,浓硫酸的质量增加了 10.8g;再通过灼热的氧化铜时,氧化铜的质量减轻了 3.2g;又通过碱石灰时,碱石灰的质量增加了17.6g。该有机物的化学式是( )
A. C2H4 B. C2H6O2 C. C2H6O D. C3H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】严重雾霾天气的产生与汽车排放的NO2(N2O4)、CO、NO等气体有关。回答下列问题:
(1)用活性炭对尾气进行处理,发生如下反应:
反应a:C(s)+NO2(g)![]() 1/2N2(g)+CO2(g) ΔH=-32.1kJ·mol1
1/2N2(g)+CO2(g) ΔH=-32.1kJ·mol1
反应b:2C(s)+N2O4(g)![]() N2(g)+2CO2(g) ΔH=-28.2kJ·mol1
N2(g)+2CO2(g) ΔH=-28.2kJ·mol1
则NO2生成N2O4的热化学方程式为____。
(2)用活性炭处理尾气时还可发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
时间/min 浓度/mol·L1 物质 | 0 | 5 | 10 | 15 | 20 | 25 |
NO | 1.20 | 0.74 | 0.56 | 0.56 | 0.63 | 0.63 |
N2 | 0 | 0.23 | 0.32 | 0.32 | 0.36 | 0.36 /td> |
①15 min后,只改变某一条件,反应重新达到平衡;根据上表数据判断改变的条件可能是___(填字母)。
a.适当缩小容器的体积 b.加入适量的活性炭
c.通入适量的NO d.适当升高温度
②0~10 min内,CO2的平均反应速率v(CO2)=___。
(3)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在密闭容器中加入足量的C和一定量的N2O4气体,维持温度T2℃,在不同压强下发生(1)中反应b,经过相同时间N2O4的转化率随压强变化如图所示:

在1.1×106 Pa时该反应的化学平衡常数Kp=___(结果保留两位有效数字。已知:气体分压(p分)=气体总压(p总)×体积分数)。
(4)用I2O5吸收汽车尾气中的CO,发生I2O5(s)+5CO(g)![]() 5CO2(g)+I2(g) ΔH=Q,在容积为1 L的密闭容器中充入5 mol CO和足量的I2O5模拟该反应。
5CO2(g)+I2(g) ΔH=Q,在容积为1 L的密闭容器中充入5 mol CO和足量的I2O5模拟该反应。
①测得CO的平衡转化率随温度变化的关系如图,下列说法正确的是____(填字母)。

A.Q<0
B.从X点到Y点可通过通入CO实现
C.从Y点到Z点可通过增大压强实现
D.600 K时,Y点CO的v正<v逆
②已知Y点的坐标为(600K,0.6),在此条件下I2(g)的体积分数为___。(精确到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据下列信息完成所需回答的问题:
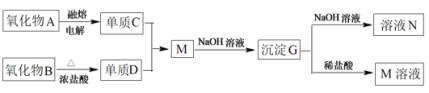
其中氧化物A是白色固体;氧化物B是黑色固体;单质D为有毒的黄绿色气体,单质C不溶于冷的浓硝酸。
(1)D是_______;G是_______(填化学式)
(2)写出下列反应的离子方程式:M+NaOH溶液生成G_____________________、G+NaOH溶液生成N______________________________________________________。
(3)单质C不溶于冷的浓硝酸的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验不能达到实验目的的是
|
|
A、研究浓度对反应速率的影响 | B、研究阳离子对 |
|
|
C、研究沉淀的转化 | D、研究酸碱性对平衡移动的影响 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定![]() 溶液先升温再降温过程中的
溶液先升温再降温过程中的![]() ,数据如下表。实验过程中,取①、④时刻的溶液,加入盐酸酸化的
,数据如下表。实验过程中,取①、④时刻的溶液,加入盐酸酸化的![]() 溶液做对比实验,④产生白色沉淀多。下列说法不正确的是
溶液做对比实验,④产生白色沉淀多。下列说法不正确的是
时刻 | ① | ② | ③ | ④ |
温度 | 25 | 30 | 40 | 25 |
| 9.66 | 9.52 | 9.37 | 9.25 |
A. ![]() 溶液中存在水解平衡:
溶液中存在水解平衡:![]()
B. ④产生的白色沉淀是![]()
C. ①→③的过程中,![]() 在降低
在降低
D. ①→③的过程中,温度与![]() 相比,前者对水解平衡的影响更大
相比,前者对水解平衡的影响更大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换等方面应用广泛。
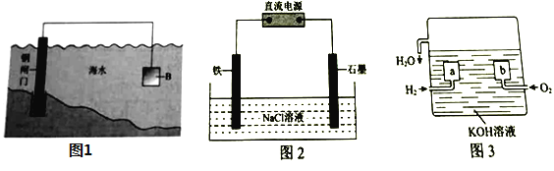
(1)①钢铁在海水中容易发生电化学腐蚀,负极反应式是____________。
②图1中,为减缓钢闸门的腐蚀,材料![]() 可以选择____________(填“
可以选择____________(填“![]() ”或“
”或“![]() ”)。
”)。
(2)图2为钢铁防护模拟实验装置,则铁做_________极,检测钢铁保护效果的方法是:取少量铁电极附近的溶液于试管中,___________,则说明保护效果好。
(3)氢氧燃料电池是一种新型的化学电源,其构造如图3所示:![]() 为多孔石墨电极,通入的气体由孔隙中逸出,并在电极表面放电。
为多孔石墨电极,通入的气体由孔隙中逸出,并在电极表面放电。
①![]() 的电极反应式是__________________;
的电极反应式是__________________;
②若电池共产生![]() 水,则电路中通过了___________
水,则电路中通过了___________![]() 的电子。
的电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 在NH![]() 和[Cu(NH3)4]2+中都存在配位键
和[Cu(NH3)4]2+中都存在配位键
B. 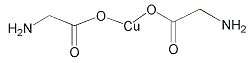 σ键和π键比例为7:1
σ键和π键比例为7:1
C. C![]() 与O
与O![]() 互为等电子体,1 mol O
互为等电子体,1 mol O![]() 中含有的π键数目为2NA
中含有的π键数目为2NA
D. 已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com