
分析 (1)碱或强碱弱酸盐其溶液都呈碱性;
(2)pH=-lgc(H+);
(3)醋酸钠促进水电离,根据氢离子浓度结合水的离子积常数计算氢氧根离子浓度;
(4)醋酸根离子在溶液中水解生成氢氧根离子,溶液显碱性;
(5)根据Na2CO3在溶液中的行为来分析:Na2CO3 =2Na++CO32-;CO32-+H2O?HCO3-+OH-;HCO3-+H2O?H2CO3+OH-;H2O?H++OH-.
解答 解:(1)碱或强碱弱酸盐其溶液都呈碱性,氢氧化钠、氨水、醋酸钠、碳酸钠溶液都呈碱性,
故答案为:②④⑤⑦;
(2)常温下0.01mol/L HCl溶液中c(H+)=0.01mol/L,pH=-lgc(H+)=-lg0.01=2,故答案为:2;
(3)醋酸钠促进水电离,醋酸钠溶液中氢离子浓度为10-11mol/L,根据水的离子积常数知,氢氧根离子浓度等于10-3 mol/L,
故答案为:10-3 mol/L;
(4)醋酸根离子在溶液中水解生成氢氧根离子,溶液显碱性,其水解离子方程式为:CH3COO-+H2O?CH3COOH+OH-;
故答案为:CH3COO-+H2O?CH3COOH+OH-;
(5)由于盐类的水解程度很小,故离子浓度大小关系为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
点评 本题考查了弱电解质的电离、溶液PH计算、盐类水解等知识点,根据弱电解质电离特点来分析解答,明确盐类水解实质是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
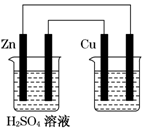
| A. | 铜在原电池中作负极,在电镀池中作阳极 | |
| B. | 原电池溶液增加的质量比电镀池阴极增加的质量大 | |
| C. | 锌棒每减少0.65 g,导线上转移的电子就为0.02 mol | |
| D. | 电镀池中的电解质溶液可用ZnSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡能导电的物质一定是单质 | |
| B. | 金属单质都能与稀硫酸发生置换反应 | |
| C. | 在化学反应中,金属单质失电子,常作还原剂 | |
| D. | 活泼金属都能从盐溶液中置换出较不活泼的金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
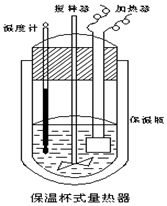 在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )
在如图所示的量热计中,将100mL 0.50mol•L-1 CH3COOH 溶液与100mL 0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为 4.184J•g-1•℃-1,两溶液的密度均约为1g•mL-1,下列说法错误的是( )| A. | 该实验测得的中和热△H为-53.3kJ•mol-1 | |
| B. | 若量热计的保温瓶绝热效果不好,则所测得的△H偏大 | |
| C. | CH3COOH溶液与NaOH溶液的反应为吸热反应 | |
| D. | 所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 纯净物 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | 碱石灰 | 烧碱 | 氧化铝 | 二氧化碳 |
| B | NH3•H2O | 小苏打 | 氧化镁 | 二氧化氮 |
| C | 五水硫酸铜 | 纯碱 | 氧化钠 | 三氧化硫 |
| D | H2O2 | 苏打 | 过氧化钠 | 二氧化硫 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下反应2M2++Z2═2M3++2Z-可以发生 | |
| B. | Z元素在反应①中被还原,在③中被氧化 | |
| C. | 氧化性强弱顺序为:XO4->Z2>R2>M3+ | |
| D. | 还原性强弱顺序为:X2+<Z-<R-<M2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L空气中O2、N2分子总数目为NA | |
| B. | 0.1 mol羟基中所含电子数目为NA | |
| C. | 28 g乙烯、丙烯混合气体中所含原子数为6NA | |
| D. | 5.6 g铁与硝酸完全反应时转移的电子数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量硫酸铝与纯碱反应:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ | |
| B. | 硫酸铜与烧碱反应:CuSO4+2OH-═Cu(OH)2↓+SO42- | |
| C. | 苯酚与碳酸钠反应:2C6H5OH+CO32-═2C6H5O-+CO2↑+H2O | |
| D. | 碳酸钡与硫酸反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com