
【题目】实验室用SO2还原MnO2制备MnSO4的装置如图所示,下列说法正确的是( )
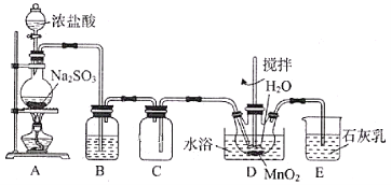
A.装置B中试剂可为Na2SO3溶液,其作用是除去SO2中的HCl
B.装置D中水浴温度应控制在80℃左右,温度过高时反应速率可能减慢
C.将装置D中所得MnSO4溶液蒸干可获得纯净的MnSO4·H2O
D.装置E中发生反应的离子方程式为SO2+2OH-=SO32-+H2O
【答案】B
【解析】
A装置中,2HCl+Na2SO3=2NaCl+H2O+SO2↑,生成SO2气体,但是会有HCl气体挥发出来,B装置用来吸收HCl,选用饱和NaHSO3溶液。C装置为安全瓶,防倒吸,D装置发生反应:MnO2+SO2=MnSO4,制得MnSO4,E装置吸收过量的SO2,防止汚染空气。
A.Na2SO3溶液能与SO2反应,故装置B中的试剂不能是Na2SO3溶液,可用饱和NaHSO3溶液,A错误;
B.当温度过高时,SO2在水中的溶解度减小,反应速率减慢,B正确;
C.MnSO4H2O受热易分解,故不能将溶液蒸干,可用蒸发浓缩、冷却结晶、过滤的方法得到MnSO4H2O, C错误;
D.石灰乳是悬浊液,不能拆写,因此反应的离子方程式为SO2+Ca(OH)2=CaSO3+H2O,D错误。
故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】传感器可以检测空气中SO2的含量,传感器的工作原理如图所示。下列叙述中正确的是( )
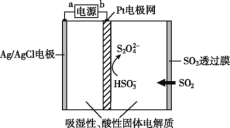
A.b为电源的正极
B.阳极的电极反应式为Ag++Cl-=AgCl
C.当电路中电子转移5×10-5 mol时,进入传感器的SO2为1.12 mL
D.阴极的电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式,下列判断正确的是
①I2(g)+H2(g) ![]() 2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
②I2(s)+H2(g) ![]() 2HI(g) ΔH=+26.48 kJ/mol
2HI(g) ΔH=+26.48 kJ/mol
A. 254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含能量相差17.00 kJ
C. 反应②的反应物总能量比反应①的反应物总能量低
D. 当反应②吸收52.96 kJ热量时转移2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与工农业生产及人们的日常生活密切相关。回答下列问题:
(1)利用某废铜下脚料(主要成分是![]() )可制备硫酸铜晶体(蓝矾),制备方法如图所示:
)可制备硫酸铜晶体(蓝矾),制备方法如图所示:
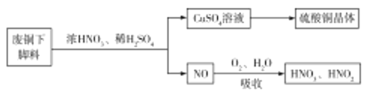
①蓝矾的化学式为:____________。
②废铜与浓硝酸,稀硫酸反应的化学方程式为______________。
(2)工业上制备尿素的反应是:![]() 。一定温度下,在容积为
。一定温度下,在容积为![]() 的恒溶液密闭容器中加入
的恒溶液密闭容器中加入![]() 和
和![]() ,反应过程中有关物质的物质的量(n)与时间的关系如图所示,
,反应过程中有关物质的物质的量(n)与时间的关系如图所示,![]() 是反应达到平衡状态。
是反应达到平衡状态。
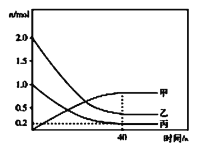
①曲线甲表示的物质是__________(写化学式)。反应开始至达到平衡时,平均反应速率![]() __________
__________![]() ,
,![]() 的平衡转化率是__________。
的平衡转化率是__________。
②升高温度,平衡__________(填“不移动”“向正反方向移动”或“向逆反应方向移动”,下同);及时从容器中分离出尿素,平衡__________。
(3)用![]() 电极作阳极可处理酸化后的亚硝酸盐污水,使
电极作阳极可处理酸化后的亚硝酸盐污水,使![]() 转化为无害气体,且溶液逐渐变为黄色,则
转化为无害气体,且溶液逐渐变为黄色,则![]() 转化为无害气体的离子方程式为__________。
转化为无害气体的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的______。(填序号)
①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
(2)下列可以证明H2(g)+I2(g) ![]() 2HI(g)已达平衡状态的是______。(填序号)
2HI(g)已达平衡状态的是______。(填序号)
①单位时间内生成n mol H2的同时,生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③百分含量w(HI)=w(I2) ④反应速率v(H2)=v(I2)=v(HI)
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1
⑥温度和体积一定时,生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和体积一定时,容器内气体颜色不再变化
⑨条件一定,混合气体的平均相对分子质量不再变化
(3)已知下列反应的平衡常数:①H2(g)+S(s) ![]() H2S(g),K1;
H2S(g),K1;
②S(s)+O2(g) ![]() SO2(g),K2;则反应H2(g)+SO2(g)
SO2(g),K2;则反应H2(g)+SO2(g) ![]() O2(g)+H2S(g)的平衡常数是______。(用K1,K2 的代数式表示)
O2(g)+H2S(g)的平衡常数是______。(用K1,K2 的代数式表示)
(4)已知:①2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ/mol
②2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g)的ΔH为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,把0.5molN2O4气体通入容积为5L的密闭容器中,60s时达到平衡,此时容器内的压强为起始时的1.6倍,求:
(1)在这60s内NO2的平均生成速率;_______
(2)达到平衡时N2O4的分解率。_______
(3)达到平衡时NO2 的体积百分含量_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景,可用Pt/Al2O3、Pd/C、 Rh/SiO2等作催化剂,采用如下反应来合成甲醇:2H2 (g)+CO(g)CH3OH(g)
(1)下表所列数据是各化学键的键能,该反应的ΔH=_______(用含字母的代数式表示)。
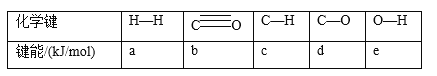
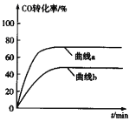
(2)某科研小组用Pd/C作催化剂,在450℃时,研究了n(H):n(CO)分别为2:1、3:1时CO转化率的变化情况(如图),则图中表示n(H2):n(CO)=3:1的变化曲线为______(填“曲线a"或“曲线b”)。
(3)某化学研究性学习小组模拟工业合成甲醇的反应,在2L的恒容密闭容器内充入1 mol CO和2molH2,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
则从反应开始到20min时,CO的平均反应速率为________,该温度下的平衡常数K为_______.
(4)将CO和H2加入密闭容器中,在一定条件下发生反应:CO(g)+2H2(g) CH3OH(g) ΔH<0。平衡时CO的体积分数(%)与温度和压强的关系如下图所示(虚线框表示没有测定该条件下的数据)。
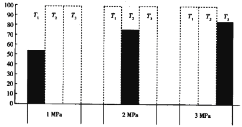
T1、T2、T3由大到小的关系是_________,判断理由是____________
(5)美国的两家公司合作开发了多孔硅甲醇直接燃料电池,其工作原理如图
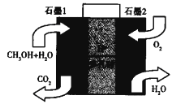
①石墨2为__________ (填“正“或“负“)极。
②石墨1极发生的电极反应式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学用语不正确的是
A.铝制餐具不宜长期存放酸性食物:2Al+6H+=2Al3++3H2↑
B.用NaHCO3溶液除去CO2中的HCl气体:HCO3-+H+=CO2↑ +H2O
C.口罩中无纺布纤维聚丙烯的合成:nCH3CH=CH2![]()
![]()
D.硬塑料中酚醛树脂的合成: 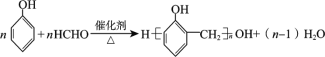
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、D、E、F、G均为短周期主族元素,且原子序数依次增大,只有E为金属元素。已知A原子只有一个电子层;E、F的原子序数分别是B、D的2倍,其中D、F同主族,B、E不同主族。回答下列问题:
(1)元素D在周期表中的位置____。
(2)F和G形成的化合物,分子中所有原子均为8电子稳定结构,该化合物的电子式为____。
(3)由上述元素组成的物质中,按下列要求写出化学方程式
①两种弱酸反应生成两种强酸______;
②置换反应,且生成物在常温均为固态____。
(4)在D、F、G中选取2种元素组成具有漂白、杀菌作用的化合物___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com