(2010?湘潭三模)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图甲装置进行有关实验,请回答:
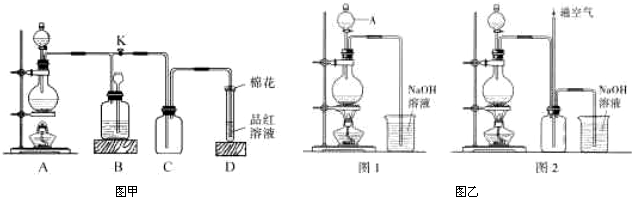
(1)装置D中试管口放置的棉花中应浸一种液体,这种液体的作用是
防止SO2扩散而造成污染气体
防止SO2扩散而造成污染气体
.
(2)装置B的作用是贮存多余的气体,B中应放置的液体是(填字母)
d
d
.
a.NaOH溶液 b.酸性KmnO
4溶液 c.浓溴水 d.饱和NaHSO
3溶液
当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是
长颈漏斗导管中液柱升高
长颈漏斗导管中液柱升高
.
(3)铜不能与稀硫酸直接反应得到硫酸铜,但可用下面方法制取:将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发浓缩、冷却结晶可制得硫酸铜晶体(装置如图乙图1、2所示).
①将硝酸分多次加入到铜粉与稀硫酸的混合物中,写出该反应的离子方程式
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.
②已知NO不能被NaOH溶液直接吸收,但已知有如下两个反应:
NO+NO
2+2NaOH=2NaNO
2+H
2O;2NO
2+2NaOH=NaNO
3+NaNO
2+H
2O.图2是图1的改进装置,其优点除可以防止倒吸外还有:
促进氮的氧化物被充分吸收
促进氮的氧化物被充分吸收
.
(3)如果用1molCu来制取1molCuSO
4,则所需12mol/L的硝酸体积为
55.6
55.6
mL,(假设HNO
3的还原产物全为NO),若所得尾气恰好被NaOH溶液完全吸收,需通入空气的体积为
18.7L
18.7L
.(假设实验体积为标准状况下测定,并忽略装置中原有空气的影响,以上数据均保留小数点后一位.)




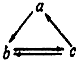 (2010?湘潭三模)下表所列各物质组中,物质a、b、c之间通过一步反应就能实现如图所示转化的是( )
(2010?湘潭三模)下表所列各物质组中,物质a、b、c之间通过一步反应就能实现如图所示转化的是( )