
| A. | Na、Mg、Al还原性依次减弱 | B. | I2、Br2、Cl2氧化性依次增强 | ||
| C. | C、N、O原子半径依次减小 | D. | P、S、Cl最高正价依次降低 |
分析 A.元素的金属性越强,其单质的还原性越强;
B.元素的非金属性越强,其单质的氧化性越强;
C.同一周期元素,原子半径随着原子序数增大而减小;
D.第三周期元素除了Ar元素外,元素的最高正化合价与其族序数相等.
解答 解:A.元素的金属性越强,其单质的还原性越强,金属性Na>Mg>Al,所以Na、Mg、Al还原性依次减弱,故A正确;
B.元素的非金属性越强,其单质的氧化性越强,非金属性Cl>Br>I,所以I2、Br2、Cl2氧化性依次增强,故B正确;
C.同一周期元素,原子半径随着原子序数增大而减小,所以C、N、O原子半径依次减小,故C正确;
D.第三周期元素除了Ar元素外,元素的最高正化合价与其族序数相等,P、S、Cl最高正价依次为+5、+6、+7,所以P、S、Cl最高正价依次升高,故D错误;
故选D.
点评 本题考查元素周期律,明确同一主族、同一周期原子结构及其性质递变规律是解本题关键,易错选项是D,注意O、F元素没有正化合价,注意规律中的异常现象,


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 汽油是含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 | |
| D. | 煤含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
| 结构式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH | (CH3O)2CO |
| 沸点(℃) | 64.7 | 7.4 | 153℃ | -24.9 | 90℃ |
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
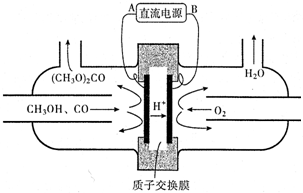
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
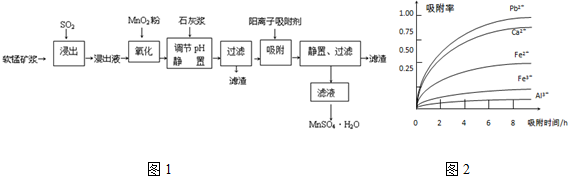
| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离汽油和煤油 | B. | 将重油分离为润滑油等 | ||
| C. | 将直链烃变为芳香烃 | D. | 十六烷变为辛烷和辛烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 初步分离酒精和水的混合物(蒸发) | |
| B. | 除去FeCl2溶液中的少量铁粉(过滤) | |
| C. | 提纯NaCl和KNO3的混合物中的KNO3(萃取) | |
| D. | 分离溴的四氯化碳溶液中的溴(分液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加适量的醋酸钠晶体后,两溶液的pH均增大 | |
| B. | 使温度都升高20℃后,两溶液的pH均不变 | |
| C. | 加水稀释2倍后,两溶液的pH均减小 | |
| D. | 加足量的锌充分反应后,盐酸中产生的氢气速率快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com