

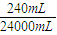 ×1mol=0.01mol,反应收集到氮气的质量是0.28g,物质的量为
×1mol=0.01mol,反应收集到氮气的质量是0.28g,物质的量为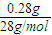 =0.01mol.B管中CuO含O:20.32 g-20.00 g=0.32 g,物质的量为
=0.01mol.B管中CuO含O:20.32 g-20.00 g=0.32 g,物质的量为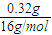 =0.02mol,n(H2O)=0.02mol,故生成的水中H元素的质量为0.02 mol×2×1g/mol=0.04g,所以气体X的质量为0.28g+0.04g=0.32g,故气体X的摩尔质量为
=0.02mol,n(H2O)=0.02mol,故生成的水中H元素的质量为0.02 mol×2×1g/mol=0.04g,所以气体X的质量为0.28g+0.04g=0.32g,故气体X的摩尔质量为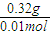 =32g/mol,故答案为:32;
=32g/mol,故答案为:32;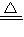 2Cu+2H2O+N2,故答案为:2CuO+N2H4
2Cu+2H2O+N2,故答案为:2CuO+N2H4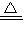 2Cu+2H2O+N2.
2Cu+2H2O+N2.

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
 某同学在实验室用如图所示的实验装置制取并收集干燥的氨气.请回答下列问题.
某同学在实验室用如图所示的实验装置制取并收集干燥的氨气.请回答下列问题.
| ||
| ||
| ||
| 高温高压 |
| ||
| 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.淀粉遇碘变蓝,因此可用碘化钾溶液检验淀粉的存在 |
| B.碘易溶于乙醇等有机溶剂,因此可用乙醇萃取碘水中的碘 |
| C.用溴水鉴别苯、乙醇、四氯化碳 |
D.用如图所示的实验装置可制取少量乙酸乙酯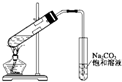 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山西省阳泉十五中高一(下)月考化学试卷(5月份)(解析版) 题型:选择题
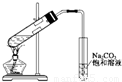
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com