
| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| C. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| D. | 取少量原溶液于试管中,加入KSCN溶液,溶液成血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
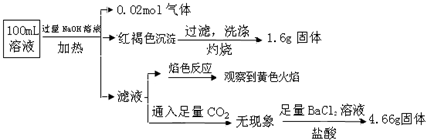
分析 加入过量NaOH溶液,加热,得到0.02mol气体,该气体为氨气,原溶液中一定存在0.02molNH4+;
产生的红褐色沉淀为氢氧化铁,1.6g固体为三氧化二铁,氧化铁的物质的量为0.01mol,则原溶液中含有0.02mol铁元素,可能为Fe3+、Fe2+,原溶液中一定没有CO32-;
滤液通入二氧化碳无现象,则原溶液中一定不存在Al3+;
4.66g不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为0.02mol,原溶液中含有0.02mol硫酸根离子;
颜色反应为黄色,则溶液中存在钠离子,由于加入了氢氧化钠溶液,无法判断原溶液中是否含有钠离子;
根据溶液电中性判断是否存在氯离子.
解答 解:加入过量NaOH溶液,加热,得到0.02mol气体,该气体为氨气,原溶液中一定存在0.02molNH4+;
产生的红褐色沉淀为氢氧化铁,1.6g固体为三氧化二铁,氧化铁的物质的量为0.01mol,则原溶液中含有0.02mol铁元素,可能为Fe3+、Fe2+,原溶液中一定没有CO32-;
滤液通入二氧化碳无现象,则原溶液中一定不存在Al3+;
颜色反应为黄色,则溶液中一定存在钠离子,由于加入了NaOH,无法判断原溶液中是否含有Na+;
4.66g不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为0.02mol,则原溶液中含有0.02mol硫酸根离子,
据电荷守恒,原溶液中一定有Cl-,物质的量至少为 0.02mol×2+0.02mol-0.02mol×2=0.02mol,
A.根据以上分析可知,原溶液中含有0.02mol铁元素,无法判断存在的是铁离子或者亚铁离子,故A错误;
B.根据以上分析,原溶液中一定存在0.02molNH4+,0.02molSO42-,0.02molFe3+、Fe2+中的一种,当铁元素全部为亚铁离子时,阳离子所带电荷的物质的量最小,所以正电荷物质的量最少为:0.02mol×2+0.02mol=0.06mol,而负电荷的物质的量为:0.02mol×2=0.04mol,根据溶液电中性可知,原溶液中一定存在Cl-,且c(Cl-)≥$\frac{0.06mol-0.04mol}{0.1L}$=0.2 mol•L-1,故B正确;
C.根据以上分析可知,原溶液中一定存在SO42-、NH4+、Cl-,只是存在Fe3+、Fe2+中的一种,其离子的物质的量为0.02mol,一定不存在CO32-、Al3+;由于第一步中加入了氢氧化钠溶液,引进了钠离子,无法确定原溶液中是否含有钠离子,故C错误;
D.检验亚铁离子时,取少量原溶液于试管中,加KSCN溶液,此时溶液现象必须是无色,然后再加入适量氯水,溶液呈血红色,则含有Fe2+,否则如果加入硫氰化钾溶液后显示红色,则无法证明原溶液中是否含有亚铁离子,故D错误;
故选B.
点评 本题考查物质分离、提纯实验方案的设计,为高频考点,把握实验流程中的试剂、发生的反应及分离方法为解答的关键,侧重分析能力、实验能力的综合考查,题目难度不大,注意根据溶液电中性判断氯离子存在的方法.


科目:高中化学 来源: 题型:解答题

| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加铝粉产生无色无味气体的溶液中:K+、Na+、Cl-、NO3- | |
| B. | 能使石蕊试液变蓝后褪色的溶液中:Na+、OH-、SO32-、I- | |
| C. | 某酸性溶液中:Fe3+、K+、SCN-、Cl- | |
| D. | 加水稀释时$\frac{c({H}^{+})}{c(O{H}^{-})}$的值明显减小的溶液:Al3+、Cl-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入HCl产生无色气体,将气体通入澄清石灰水中溶液变浑浊,说明一定有CO32- | |
| B. | 加入NaOH溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| C. | 加入AgNO3溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有Cl- | |
| D. | 加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 碱性的废水 | 用CO2中和 | 化学法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 废酸 | 加生石灰中和 | 化学法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.
煤炭燃烧会产生二氧化碳、氮氧化物等有害气体,污染环境.| 时间/min | 0 | 1 | 3 | 8 | 11 |
| n(H2)mol | 8 | 6 | 3 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间里每增加1molN2,同时减少2molNH3 | |
| B. | c(N2):c(H2):c(NH3)=1:1:1 | |
| C. | N2与H2的物质的量与NH3的物质的量相等 | |
| D. | N2、H2和NH3的质量分数不再改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com