
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
| H2CO3 | Ka1 = 4.2×10-7 | HClO | 3×10-8 |
| Ka2 = 5.6×10-11 |
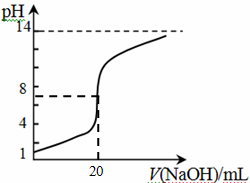
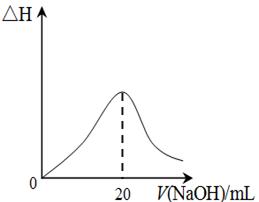
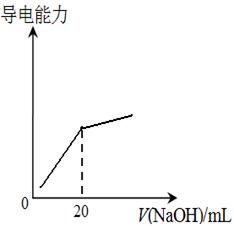
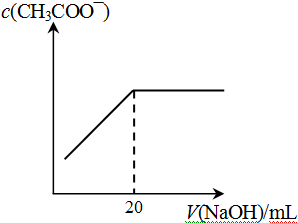


科目:高中化学 来源:不详 题型:单选题
| A.充电时作阳极,放电时作负极 | B.充电时作阳极,放电时作正极 |
| C.充电时作阴极,放电时作负极 | D.充电时作阴极,放电时作正极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
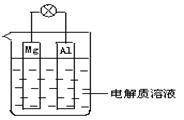
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稀NaOH溶液 | B.HCl溶液 | C.CuSO4溶液 | D.NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是| A.放电时K+ 向负极移动 |
| B.放电时负极区域的pH会增大 |
| C.充电时锌极与外电源负极相连 |
| D.充电时阳极反应为:Fe(OH)3-3e- + 5OH-="===" FeO42- + 4H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
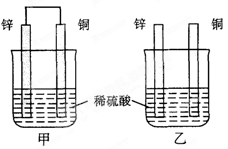
| A.甲、乙均为化学能转变为电能的装置 |
| B.乙中铜片上没有明显变化 |
| C.甲中铜片质量减少、乙中锌片质量减少 |
| D.两烧杯中溶液的c(H+)均增小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电池放电时,正极附近溶液的碱性增强 |
B.电池放电时,负极反应为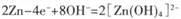 |
C.电池充电时,阳极反应为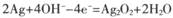 |
| D.充电时锌极与外电源正极相连 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.电池工作时,正极反应式为:O2+2H2O+4e- ="==" 4OH- |
| B.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| C.电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者 |
| D.当电池中消耗0.02gH2时,a极周围会产生0.02gH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com