
| A、2c(CO32-)+c(HCO3-)=0.1mol/L | ||||
B、
| ||||
| C、该溶液中加BaCl2溶液,溶液pH增大 | ||||
| D、在溶液中加水,使体积扩大到原来的10倍,则溶液pH明显变小 |
| c(CO32-) |
| c(HCO3-) |
| c(CO32-).c(H+) |
| c(HCO3-).c(H+) |
| Ka2 |
| c(H+) |
| c(CO32-) |
| c(HCO3-) |
| c(CO32-).c(H+) |
| c(HCO3-).c(H+) |
| Ka2 |
| c(H+) |
| 4.7×10-11 |
| 10-10 |
| c(CO32-) |
| c(HCO3-) |
| c(CO32-).c(H+) |
| c(HCO3-).c(H+) |
| Ka2 |
| c(H+) |
| 4.7×10-11 |
| 10-10 |
| c(CO32-) |
| c(HCO3-) |
| c(CO32-).c(H+) |
| c(HCO3-).c(H+) |
| Ka2 |
| c(H+) |
| 4.7×10-11 |
| 10-10 |


科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌、过滤,沉淀用蒸馏水洗涤. | 除去Mg(OH)2样品中的Ca(OH)2 |
| B | 取少量KClO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液. | 检验KClO3中的氯元素 |
| C | 向某溶液中滴加Ba(NO3)2溶液产生白色沉淀,再加稀盐酸沉淀消失. | 说明原溶液中一定含有CO32-或SO32- |
| D | 向盛有1mL 0.011mol?L-1AgNO3溶液的试管中滴加5滴0.01mol?L-1NaCl溶液,有白色沉淀生成,再向其中滴加0.01mol?L-1NaI溶液,产生黄色沉淀. | 常温下, Ksp(AgCl)>Ksp(AgI) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有阴离子的化合物一定含有阳离子,含有阳离子的化合物不一定含有阴离子 |
| B、只含化学键而无分子间作用力的化合物晶体一定是原子晶体 |
| C、质子数和电子数均相同的两种微粒不可能是一种分子和一种离子 |
| D、只有分子中所有原子均达到2个或8个电子稳定结构的分子才是稳定分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,在空气中能产生丁达尔现象 |
| B、在海轮外壳上镶嵌锌块,会减缓船体的锈蚀 |
| C、经过必要的化学变化能从海水中提取NaCl、Mg、Br2等物质 |
| D、大量燃烧化石燃料排放的废气中大量CO2、SO2,造成大气污染,从而使雨水的PH=5.6形成酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,向100mL 0.01mol?L-1 MOH溶液中逐滴加入0.02mo1?L-1 HA溶液,图中所示曲线表示混合溶液的pOH变化情况(溶液体积变化忽略不计),溶液中pOH=-lg(OH-).下列说法中,不正确的是( )
常温下,向100mL 0.01mol?L-1 MOH溶液中逐滴加入0.02mo1?L-1 HA溶液,图中所示曲线表示混合溶液的pOH变化情况(溶液体积变化忽略不计),溶液中pOH=-lg(OH-).下列说法中,不正确的是( )| A、HA为一元弱酸 |
| B、MOH为一元强碱 |
| C、N点水的电离程度大于K点水的电离程度 |
| D、K点对应的溶液的pOH=10,则有c(HA)+c(H+)-c(OH-)=0.01mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
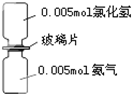 如图是氨气与氯化氢反应的装置.抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )
如图是氨气与氯化氢反应的装置.抽走玻璃片充分反应,反应中有关物理量的描述正确的是(NA表示阿伏加德罗常数)( )| A、气体反应物的总体积为0.224L |
| B、产物中所含的N-H键个数为0.02NA |
| C、生成物中含有0.005NA个分子 |
| D、加1L水溶解后所得溶液中阳离子浓度为0.005mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽油、柴油和植物油都是烃 |
| B、油脂、淀粉和蛋白质均可发生水解反应 |
| C、乙烯和苯使溴水褪色都是发生加成反应 |
| D、苯环含有碳碳单键和碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
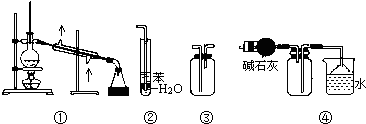
| A、装置①常用于分离互相溶解且沸点相差10℃以上的液态混合物 |
| B、装置②可用于吸收NH3或HCl气体,并防止到吸 |
| C、装置③可用于收集H2、CO2、Cl2、NH3等气体 |
| D、装置④可用于干燥、收集氨气,若将碱石灰改成五氧化二磷,可用于干燥、收集氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将11.2L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
| B、100mL 1mol?L-1 Na[Al(OH)4]溶液中含有0.1NA个[Al(OH)4]- |
| C、标准状况下,22.4L NO和22.4L O2混合后所得气体中分子总数为NA |
| D、标准状况下,1.12L 1H2和0.2g 2H2均含有0.1NA个质子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com