
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 1.44 | 9.6 | 9.6 |
| 催化剂 |
| n(H2) |
| n(CO2) |
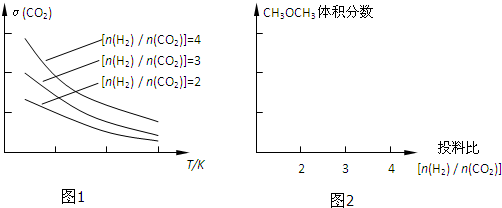
| n(H2) |
| n(CO2) |
| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
| 9.6×9.6 |
| 1.442 |
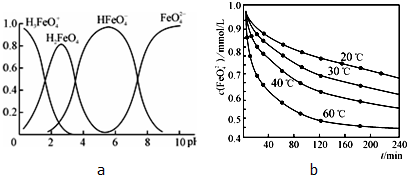
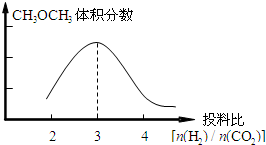 ,根据图一可以看出,对于反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0,所以温度升高,K减小,故答案为:
,根据图一可以看出,对于反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H<0,所以温度升高,K减小,故答案为: ;减小.
;减小.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
| A、摩尔是物质的数量单位 |
| B、58.5gNaCl溶解在1L水中,得到溶液的物质的量浓度为1mol/L |
| C、标况下,1molCCl4所占的体积约为22.4L |
| D、12g12C含有的碳原子数约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 表示碳原子,用
表示碳原子,用 表示氧原子,用
表示氧原子,用 表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题:
表示氮原子,如图为气体转换的微观过程.请你根据图示回答下列问题: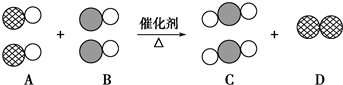
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用广泛pH试纸测得氯水的pH为2 |
| B、用托盘天平称取10.50g干燥的NaCl固体 |
| C、配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液的浓度偏高 |
| D、制备Fe(OH)2时,向FeSO4溶液中滴入NaOH溶液时,胶头滴管不能伸入液面以下 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
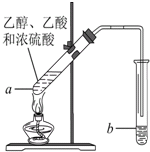 在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a的取值范围为0.9g<a<1.2g |
| B、镁铝合金与盐酸反应时转移电子的数目为0.1NA |
| C、镁铝合金与盐酸反应产生H2的体积在常温常压下大于1.12L |
| D、x=2y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com