(1)10个电子的微粒有:分子:CH
4、NH
3、H
2O、HF、Ne;阴离子:N
3-、O
2-、F
-、OH
-、NH
2-;
阳离子:Na
+、Mg
2+、Al
3+、NH
4+、H
3O
+.
根据X与Z分子中含有的共用电子数之比为3:4,即可确定X为NH
3,含有3对共用电子对;Z为CH
4,含有4对共用电子对.
实验室制取氨气的原理为:氨盐+碱
氨气,氨盐通常用NH
4Cl,碱通常用Ca(OH)
2.
则X的电子式:
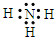
,实验室制取氨气的方程式为:Ca(OH)
2+2NH
4Cl
CaCl
2+2NH
3↑+2H
2O.
故答案为:
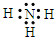
;Ca(OH)
2+2NH
4Cl
CaCl
2+2NH
3↑+2H
2O;
(2)根据W+X+H
2O→白色沉淀,W为离子,X为NH
3,溶于水即得氨水,能与氨水反应生成白色沉淀的离子W可能为
Mg
2+、Al
3+,生成的白色沉淀可能为Mg(OH)
2、Al(OH)
3,Mg(OH)
2白色沉淀不与NaOH反应,Al(OH)
3白色沉淀与
NaOH反应,方程式为:Al(OH)
3+NaOH═NaAlO
2+2H
2O,使白色沉淀消失.所以为进一步确定W离子,只需取上述白色沉淀少量置于试管中,加氢氧化钠溶液,观察是否溶解,若能溶解则W是Al
3+,若不能溶解则W是Mg
2+.
故答案为:加入氢氧化钠溶液(或足量氢氧化钠溶液),若观察到白色沉淀溶解(或白色沉淀全部溶解),则证明W为Al
3+;若观察到白色沉淀不溶解,则证明W为Mg
2+;
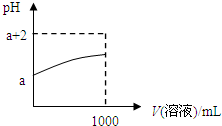
(3)根据Y为分子,且常温下取10ml pH=a的Y的稀溶液,加水稀释时pH随溶液体积的变化而增大,
稀释至1000ml时PH<a+2,则Y的水溶液为弱酸,即为氢氟酸,Y化学式为HF.
下列叙述中①Y溶于水部分电离,由于氢氟酸为弱酸,是弱电解质,所以电离程度为部分电离.故①正确;
②稀释后所有离子的浓度均减小,由于溶液体积增大,c(H
+)、c(F
-)都减小,而溶液中c(H
+)?c(OH
-)═10
-14是一个恒定的值,C(H
+)减小,则C(OH
-)增大,故②错误;
③Y的水溶液通常保存在玻璃瓶中,由于氢氟酸能与玻璃反应,方程式为:SiO
2+4HF═SiF
4+2H
2O,所以不能保存在玻璃瓶中,故③错误;
④稀释后,阴离子的物质的量浓度之和增大,根据溶液中电荷守恒:C(H
+)═C(F
-)+C(OH
-),而C(H
+)减小,所以阴离子的物质的量浓度之和也减小,故④错误.
故答案为:HF;①;
(4)已知H
2的燃烧热为285.8kJ/mol.其热化学方程式为:H
2(g)+
O
2(g)
H
2O(l);△H═-285.8kJ/mol.
Z为CH
4,其燃烧化学方程式为:CH
4(g)+2O
2(g)=CO
2(g)+2H
2O(1)
设混合气体中H
2的物质的量为x,CH
4的物质的量为y,
1molH
2转移电子的物质的量为2mol,CH
4中碳为-4价,CO
2中碳为+4价,则1molCH
4转移电子的物质的量为8mol,
H
2(g)+
O
2(g)
H
2O(l);△H═-285.8kJ/mol
CH
4(g)+2O
2(g)=CO
2(g)+2H
2O(1)
则:
解得:
即0.1molH
2放出的热量为28.58kJ,0.1molCH
4放出的热量为117.6kJ-28.58kJ,为89.02 kJ,
则1molCH
4放出的热量为890.2 kJ,故热化学方程式为:CH
4(g)+2O
2(g)=CO
2(g)+2H
2O(1)△H=-890.2 kJ/mol.
CH
4中碳元素化合价为-4价,燃烧转变为CO
2中碳为+4价,失去8e
-,同时在KOH溶液中反应转变为CO
32-和H
2O,结合电荷守恒配平可得电极反应式:CH
4-8e
-+10 OH
-=CO
32-+7H
2O,
故答案为:CH
4(g)+2O
2(g)=CO
2(g)+2H
2O(1)△H=-890.2 kJ/mol;CH
4-8e
-+10OH
-=CO
32-+7H
2O.

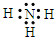
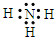


 阅读快车系列答案
阅读快车系列答案