
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
分析 分子:核外电子数=质子数;阳离子:核外电子数=质子数-电荷数:阴离子核外电子数=质子数+电荷数.
解答 解:①H3O+质子数为11,电子数为10;NH4+质子数为11,电子数为10;Na+质子数为11,电子数为10,故三者具有相同质子数和电子数;
②O2-质子数为8,电子数为10;Na+质子数为11,电子数为10;Mg2+质子数为12,电子数为10,故三者具有不同的质子数和相同的电子数;
③OH-质子数为9,电子数为10;NH2-质子数为9,电子数为10;F-质子数为9,电子数为10,故三者具有相同质子数和电子数;
④CH4质子数为10,电子数为10;NH3质子数为10,电子数为10;H2O质子数为10,电子数为10,故三者具有相同质子数和电子数;
故具有相同质子数和电子数的①③④,
故选B.
点评 本题考查微粒中质子数和电子数的判断,难度不大.要注意质子数与核外电子数的关系.


科目:高中化学 来源: 题型:选择题
| A. | 正丁烷的燃烧热大于异丁烷,故正丁烷分子中的碳氢键比异丁烷的多 | |
| B. | 正丁烷的稳定性大于异丁烷 | |
| C. | 正丁烷转化为异丁烷的过程是一个放热过程 | |
| D. | 正丁烷分子储存的能量小于异丁烷分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
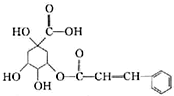
| A. | 分子式为C16H16O7 | |
| B. | 能与钠、乙醇、乙酸、溴发生反应,不能与碳酸钠发生反应 | |
| C. | 能发生取代反应、氧化反应、加成反应,不能发生水解发应 | |
| D. | 1mol 该有机物最多能与2mol NaOH或4mol H2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) 气体总浓度 (mol/L) 时间(min) | 15 | 25 | 35 |
| 0 | 0 | 0 | 0 |
| t1 | 9×10-3 | 2.7×10-2 | 8.1×10-2 |
| t2 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |
| t3 | 3×10-2 | 4.8×10-2 | 9.4×10-2 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(OH-)减小 | |
| B. | 对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 | |
| C. | 25℃下,在NH3•H2O稀溶液中,加水,$\frac{c({H}^{+})•c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$的值不变 | |
| D. | 在NaHS溶液中,滴入少量CuCl2溶液产生黑色沉淀,HS-水解程度增大,pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
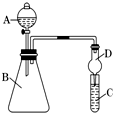 Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.
Ⅰ.某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com