
| A. | 用食醋除去暖水瓶中的水垢 | |
| B. | 用热的纯碱溶液洗涤餐具上的油 | |
| C. | 用米汤检验食盐中是否含碘酸钾 | |
| D. | 用灼烧并闻气味的方法区别纯棉和纯羊毛织物 |
分析 A.强酸能和弱酸盐反应生成弱酸;
B.油脂在碱性条件下水解生成高级脂肪酸钠和甘油;
C.碘遇淀粉试液变蓝色;
D.羊毛属于蛋白质,蛋白质灼烧具有烧焦羽毛的气味.
解答 解:A.醋酸酸性大于碳酸,醋酸能和碳酸钙反应生成可溶性的醋酸钙,所以用食醋除去暖水瓶中的水垢,故A正确;
B.碳酸钠是强碱弱酸盐,易水解而使其溶液呈碱性,升高温度促进碳酸钠水解,导致其溶液碱性增强,油脂在碱性条件下水解生成高级脂肪酸钠和甘油,所以用热的纯碱溶液洗涤餐具上的油,故B正确;
C.碘遇淀粉试液变蓝色,碘酸钾中不含碘单质,所以遇淀粉试液不变蓝色,故C错误;
D.羊毛属于蛋白质,蛋白质灼烧具有烧焦羽毛的气味,纯棉属于多糖,灼烧没有烧焦羽毛的气味,所以可以采用灼烧法鉴别纯棉和羊毛,故D正确;
故选C.
点评 本题考查化学与生活,涉及乙酸的性质、油脂的性质及物质检验、鉴别,明确物质性质是解本题关键,会运用化学知识解释生活现象,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
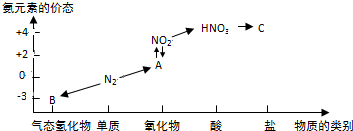
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
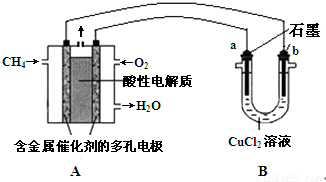
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②④ | C. | ②③ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
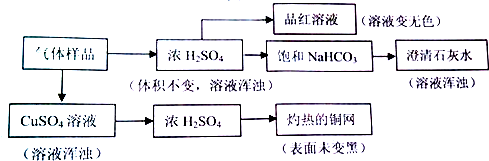
| A. | 能使品红溶液褪色,说明原气体样品中至少含有Cl2或SO2 | |
| B. | 灼热的铜网未变黑,说明原气体样品中一定不含有O2 | |
| C. | 澄清石灰水变浑浊,说明原气体样品中含有SO2,不能确定是否含有CO2 | |
| D. | 经过硫酸铜溶液,溶液变浑浊,说明原气体样品中含有H2S,则可排除SO2、Cl2的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①⑤ | C. | ①②③⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com