
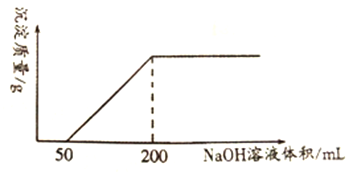
【题目】一定量铜与100mLcmol/L的稀硝酸反应,产生1.12LNO(标准状况),反应结束后,向反应后的溶液中滴加1.0mol/L的NaOH溶液,滴加过程中,产生沉淀的质量与加入NaOH 溶液的体积关系如下图所示。
回答下列问题:
(1)写出铜与稀硝酸反应的离子方程式_____________________________________________。
(2)铜与稀硝酸反应中被还原HNO3的物质的量为________mol。
(3)铜与稀硝酸反应后的溶液中,H+的物质的量浓度为________mol/L(反应前后溶液体积变化忽略不计)。
(4)稀硝酸的物质的量浓度c=______mol/L。
(5)将铜与稀硝酸反应生成的NO通入NaOH 溶液中,并加入20%的H2O2水溶液使其全部转化为NaNO3,反应的化学方程式是______________________________________。
【答案】3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O 0.05 0.5 2.5 2NO+2NaOH+3H2O2=2NaNO3+4H2O
【解析】
(1)铜和稀硝酸反应生成硝酸铜、NO和水;
(2)铜与稀硝酸反应中被还原HNO3反应后生成NO,由氮原子守恒来计算;
(3)反应结束后,向反应后的溶液中滴加1.0mol·L-1的NaOH溶液时,NaOH先和H+反应,将H+反应完后,再去和Cu2+反应,由图示,剩余的H+反应消耗50mLNaOH溶液;
(4)当加入氢氧化钠溶液200mL时,溶液中的H+、Cu2+反应完全,溶液中的溶质为NaNO3,据此求出溶液中n(NO3-),然后根据稀硝酸中n(HNO3)=n(NO3-)+n(NO)求出硝酸的物质的量,稀硝酸的浓度;
(5)将铜与稀硝酸反应生成的NO通入NaOH 溶液中,并加入20%的H2O2水溶液,则NO做还原剂被氧化为NaNO3,双氧水被还原。
(1)铜和稀硝酸反应生成硝酸铜、NO和水,故离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)铜与稀硝酸反应中被还原的HNO3反应后生成NO,而反应生成的NO的物质的量为0.05mol,根据1mol硝酸被还原则生成1molNO可知,被还原的硝酸为0.05mol;
(3)反应结束后,向反应后的溶液中滴加1.0mol·L-1的NaOH溶液时,NaOH先和H+反应,将H+反应完后,再去和Cu2+反应,根据图示可知,剩余的H+反应消耗50mLNaOH溶液,根据1molH+~1molNaOH可知,反应后的溶液中氢离子的物质的量n(H+)=n(NaOH)=cV=1mol·L-1×0.05L=0.05mol,则c(H+)=n(H+)/V=0.05mol÷0.1L=0.5mol·L-1;
(4)当加入氢氧化钠溶液200mL时,溶液中的H+、Cu2+反应完全,溶液中的溶质只有NaNO3,故溶液中的n(NO3-)=n(Na+)=n(NaOH)=1mol·L-1×0.2L=0.2mol,而原稀硝酸中n(HNO3)=n(NO3-)+n(NO)=0.2mol+0.05mol=0.25mol,故稀硝酸的浓度c=0.25mol÷0.1L=2.5mol·L-1;
(5)将铜与稀硝酸反应生成的NO通入NaOH 溶液中,并加入20%的H2O2水溶液,则NO做还原剂被氧化为NaNO3,双氧水被还原为H2O,故化学方程式为2NO+2NaOH+3H2O2=2NaNO3+4H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化合物YX2、ZX2中X、Y、Z都是前三周期元素,X与Y同周期,Y与Z同主族,Y元素的最外层p轨道上的电子数等于前一电子层电子总数;X原子最外层的p轨道中有一个轨道填充了2个电子。则
(1)X元素基态原子的电子排布式是________,Y原子的价层电子的电子排布图是_________。
(2)YX2的分子构型是____________。
(3)YX2分子中,Y原子的杂化类型是__________,一个YX2分子中含________个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是 ( )

A.W、R元素单质分子内都存在非极性键
B.X、Z元素都能形成双原子分子
C.键长W—H<Y—H,键的极性Y—H>W—H
D.键长X—H<W—H,键能X—H<W—H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从实验测得不同物质中氧—氧之间的键长和键能的数据如下表:
O—O键 数据 | O | O | O2 | O |
键长/10-12m | 149 | 128 | 121 | 112 |
键能/kJ·mol-1 | x | y | z=494 | w=628 |
其中x、y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w>z>y>x。该规律性是( )
A. 成键时电子数越多,键能越大 B. 键长越短,键能越大
C. 成键所用的电子数越少,键能越小 D. 成键时电子对越偏移,键能越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO等)制备草酸镍晶体的流程如下:
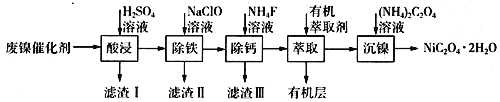
(1)请写出一种能提高“酸浸”速率的措施:________________________;滤渣I的成分是____________(填化学式)。
(2)除铁时,控制不同的条件可以得到不同的滤渣II。已知滤渣II的成分与温度、pH的关系如图所示:
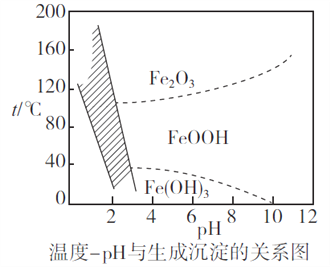
①若控制温度40℃、pH=8,则滤渣II的主要成分为_________________________(填化学式)。
②若控制温度80℃、pH=2,可得到黄铁矾钠[Na2Fe6(SO4)4(OH)12](图中阴影部分),写出生成黄铁矾钠的离子方程式:___________________________________________。
(3)已知除铁后所得100 mL溶液中c(Ca2+)=0.01mol·L-1,加入100 mL NH4F溶液,使Ca2+恰好沉淀完全即溶液中c(Ca2+)=1×10-5 mol·L-1,则所加c(NH4F)=_________mol·L-1。[已知Ksp(CaF2)=5.29×10-9]
(4)加入有机萃取剂的作用是________________________。
(5)某化学镀镍试剂的化学式为MxNi(SO4)y(M为+1价阳离子,Ni为+2价,x、y均为正整数)。为测定该镀镍试剂的组成,进行如下实验:
I.称量28.7g镀镍试剂,配制100 mL溶液A;
Ⅱ.准确量取10.00 mL溶液A,用0.40 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液25.00mL;
Ⅲ.另取10.00 mL溶液A,加入足量的BaCl2溶液,得到白色沉淀4.66g。
①配制100 mL镀镍试剂时,需要的仪器除药匙、托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要________________________。
②该镀镍试剂的化学式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g) ![]() 2HI(g) △H=-a kJ/mol.已知:
2HI(g) △H=-a kJ/mol.已知:
![]() (a、b、c均大于零)。
(a、b、c均大于零)。
下列说法正确的是
A.H2、I2和HI分子中的化学键都是非极性共价键
B.断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ
C.相同条件下,1 mol H2 (g)和1mol I2 (g)总能量小于2 mol HI (g)的总能量
D.向密闭容器中加入2 mol H2 (g)和2 mol I2 (g),充分反应后放出的热量为2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为: ____________________________,
Y元素原子最外层电子的电子排布图为:____________________________。
(2)若X、Y两元素电负性分别为2.1和2.85,试判断XY4中X与Y之间的化学键为____(填“共价键”或“离子键”)。
(3)该化合物的空间结构为____,中心原子的杂化类型为____,分子为____(填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该液体微粒间的作用力是____。
(5)该化合物的沸点与SiCl4比较:____(填化学式)的高,原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组在学习了Al、Fe的性质后,设计如下实验,探究Cu的常见化合物的性质。
[实验1]探究Cu(OH)2是否具有两性
药品:CuSO4溶液、浓NaOH溶液、稀H2SO4。
实验步骤:
①取少量CuSO4溶液于试管中,逐滴加入浓NaOH溶液至产生较多蓝色沉淀,静置后过滤。
②结论:Cu(OH)2具有两性。
(1)实验步骤②的内容为______
(2)能证明Cu(OH)2具有两性的实验现象为_______
[实验2]探究Cu(I)和Cu(Ⅱ)的稳定性
实验步骤:
①取98gCu(OH)2固体,加热至80~100℃时,得到80g黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。
②冷却后称量,A的质量为72g。
③向A中加人适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。
(3)通过计算判断A的化学式为_______(不需要书写计算过程)
(4)步骤③中发生反应的离子方程式为____________
(5)根据上述实验现象得出Cu(I)和Cu(Ⅱ)的稳定性大小的结论为:固态时___________,酸性溶液中________。
[实验3]探究CuO被NH3还原的产物
该学习小组同学设计了如图所示的实验装置(夹持及尾气处理装置未面出)。实验中观察到CuO变为红色物质。查资料可知,同时生成一种无污染的气体。

(6)反应产生的无污染气体的化学式为_______
(7)有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计个简单的实验方案验证红色物质中是否含有A:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与热的氧化铜反应得到N2和金属铜,用如图中的装置可以实现该反应(夹持装置略去)。回答下列问题:
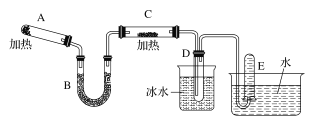
(1)A中发生反应的化学方程式是_____________。
(2)B中加入的物质是________。
(3)实验时在C中观察到的现象是________,发生反应的化学方程式是_______。
(4)检验D中收集到的物质的方法和现象是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com