
| A. | 磷酸晶体和磷酸溶液 | B. | 硝酸钾晶体和熔化的硝酸钾 | ||
| C. | 蔗糖晶体和熔化的蔗糖 | D. | 熟石灰和澄清石灰水 |
分析 水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、金属氧化物和水;
在水溶液里和熔融状态下都不导电的化合物是非电解质,包括非金属氧化物、部分非金属氢化物、大多数有机物;
单质和混合物既不是电解质,也不是非电解质.
解答 解:A.磷酸溶液属于混合物,不是电解质,故A错误;
B.硝酸钾晶体和熔化的硝酸钾都是化合物,水溶液里或熔融状态下能导电,都是电解质,故B正确;
C.蔗糖在水溶液里和熔融状态下都不导电的化合物是非电解质,故C错误;
D.澄清石灰水为混合物,不是电解质,故D错误;
故选:B.
点评 本题考查了电解质、非电解质判断,熟悉概念是解题关键,注意电解质、非电解质必须是化合物,题目较简单.


科目:高中化学 来源: 题型:解答题
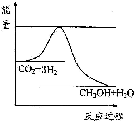 以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.
以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工.| 起始 浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醋酸是日常生活中常见的弱酸.
醋酸是日常生活中常见的弱酸.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
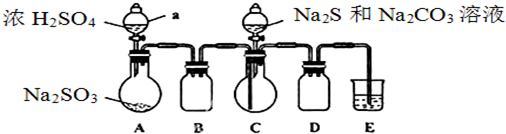
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com