
【题目】下表是实验室制备气体的有关内容:
编号 | 实验内容 | 实验原理 | 气体发生装置 |
① | 制备氧气 | H2O2→O2 | __________________ |
② | 制备二氧化硫 | Na2SO3→SO2 | __________________ |
③ | 制备氯气 | HCl→Cl2 | __________________ |
(1)上述气体中从制备过程看,必须选择合适的氧化剂才能实现的是__________________(填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是__________________;
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中。
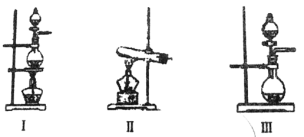
(3)某学习小组设计了如图实验,将氯气依次通过下列装置以验证氯气的性质:

①通入氯气后,A中的现象是__________________,整套实验装置存在的明显缺陷是__________________;
②C装置中发生反应的离子方程式为__________________。
③该小组同学欲设计一个实验,证明洗气瓶B中的Na2SO3己被氧化。具体操作为:取一定量的B中溶液于一洁净的试管中,向其中加入硝酸酸化的硝酸钡溶液后,若产生白色沉淀则证明已经被氧化。你认为__________________ (填“是”或“否”)合理?
【答案】
(1)Cl2;SO2;
(2)Ⅲ;Ⅲ;Ⅰ或Ⅲ
(3)①溶液变蓝色;无尾气吸收装置;
②2Fe2++Cl2═2Fe3++2Cl-.
③否。
【解析】
试题分析:(1)利用过氧化氢分解制氧气,利用亚硫酸钠与稀硫酸发生复分解反应制二氧化硫,利用二氧化锰氧化浓盐酸制氯气,所以需要氧化剂的是制备氯气,其中二氧化硫是酸性气体化合物,氧气是中性气体单质,氯气是氧化性气体单质;从反应原理看,明显不同于其他两种气体的是制备二氧化硫利用的是复分解反应;故答案为:Cl2;SO2;
(2)过氧化氢分解制氧气不需要加热选择Ⅲ,利用亚硫酸钠与稀硫酸发生复分解反应制二氧化硫,选择Ⅲ,利用二氧化锰氧化浓盐酸加热制氯气选择Ⅰ,或用高锰酸钾和浓盐酸不加热反应制氯气,选择Ⅲ;故答案为:Ⅲ;Ⅲ;Ⅰ或Ⅲ
(3)①氯气有氧化性,能和碘化钾反应生成碘单质,碘单质与淀粉变蓝,所以通入氯气后,A中的现象是溶液变蓝色;氯气有毒,不能直接排空,要用尾气处理装置处理,故答案为:溶液变蓝色;无尾气吸收装置;
②氯气有氧化性,能将二价铁氧化生成三价铁,离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-.
③硝酸具有强氧化性,能够将亚硫酸钠溶液氧化为硫酸钠,再加入硝酸钡溶液后,一定产生白色沉淀,因此不能证明亚硫酸钠已被氧化,故答案为:否。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是所有原子中半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素中,每一种都能与C元素形成原子个数比不相同的化合物。
请回答下列问题:
(1)A、C两元素形成的原子个数比为1:1的化合物,该化合物电子式为 。
(2)B元素的氢化物在催化剂存在的情况下与C元素单质反应的化学方程式为 。
(3)X的水溶液显 (填酸性、碱性或中性),原因是 (用离子方程式表示)。
(4)C和E两元素相比较,非金属性较强的是 (填“元素名称”),可以验证该结论的是 (填“序号”)。
A.比较这两种元索的气态氢化物的沸点
B.比较这两种元素的单质在常温下的状态
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(5)C、D两元素形成的原子个数比为1:1的化合物,E、C两元素形成的原子个数比为1:2的化合物,这两种化合物反应的化学方程式为 。
(6)A与C、A与E可分别形成甲、乙两种负一价双原子离子,且甲有10个电子,乙有18个电子,则甲与乙反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.垃圾是放错地方的资源,应分类回收利用
B.实现化石燃料清洁利用,就无需开发新能源
C.为提高农作物的产量和质量,应大量使用化肥和农药
D.将废弃的植物油(即“地沟油”)蒸馏可以重新作为食用油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应一定属于吸热反应的是
A.破坏生成物全部化学键所需能量小于破坏反应物全部化学键的能量
B.CH3COOH + KOH === CH3COOK + H2O
C.所有高温条件下发生的反应
D.C6H12O6(葡萄糖)+ 6O2=== 6CO2 + 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家利用“组合转化”等技术对CO2进行综合利用。如用H2 和CO2在一定条件下可以合成乙烯:6H2(g)+2CO2(g)![]() C2H4 (g)+4H2O(g) △H= a kJ/mol
C2H4 (g)+4H2O(g) △H= a kJ/mol
(1)已知:①H2和C2H4的燃烧热分别为285.8kJ/mol和1411kJ/mol
②H2O(g)= H2O(l) △H= - 44 kJ/mol
则a= kJ/mol。
(2)不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法错误的是 ____________(填序号)。
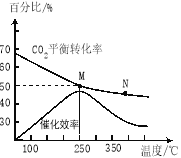
①M点的速率最大
②温度低于250℃时,随温度升高乙烯的产率增大
③M点时平衡常数比N点时平衡常数大
④为提高 CO2的转化率应在尽可能低的温度下进行反应
(3)若在密闭容器中充入体积比为 3∶1的H2和CO2,则图中M点时,产物C2H4的体积分数为 ;若要进一步提高乙烯的体积分数,可采取的措施有 。
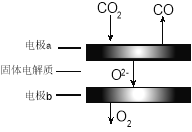
(4)利用高温电解技术可将CO2转化为高热值的燃料CO气体。
① 电极a发生的反应类型是 (填“氧化”或“还原”)反应。
② 高温电解的总反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的
B.升高高温度或加入催化剂,可以改变化学反应的反应热
C.据能量守恒定津,反应物的总能量一定等于生成物的总能量
D.物质发生化学变化一定伴随着能最变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学常见的有机化合物A(C6H6O)是重要的化工原料,在工业上能合成紫外线吸收剂BAD和治疗心脏病药物的中间体F,合成路线如下:

已知:BAD的结构简式为: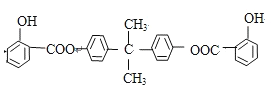
F的结构简式为: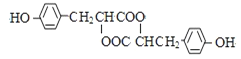
试回答:
(1)H中含有的官能团名称是 .
(2)写出X的结构简式 ,推测B的核磁共振氢谱中显示有 种不同化学环境的氢原子.
(3)写出反应类型 C→D ;E→F .
(4)1mol C与浓溴水反应,最多可以消耗 molBr2.
(5)C→D的过程中可能有另一种产物C1,请写出C1在加热条件下与足量稀NaOH水溶液
反应的化学方程式: .
(6)W的同分异构体有下列性质:与FeCl3反应,溶液呈紫色;能发生银镜反应;则该同
分异构体共有 种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后,恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为( )
A. 0.4 mol B. 0.5 mol
C. 0.6 mol D. 0.8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热条件下,将24.0gCuO和Fe2O3的混合物与足量的CO完全反应,并将反应后的气体全部通入到足量的澄清石灰水中,得到白色沉淀40.0g。下列有关叙述中不正确的是( )
A. 原混合物中CuO和Fe2O3的物质的量的比为1:1
B. 参加反应的CO的质量为11.2g
C. 原混合物中Fe元素的质量为5.6g
D. 原混合物中CuO的质量分数约为33.3%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com