
下列反应中,在高温下不能自发进行的是( )
A.CO(g) C(s)+O2(g) C(s)+O2(g) |
B.NH4Cl(s) NH3(g)↑+HCl(g)↑ NH3(g)↑+HCl(g)↑ |
C.(NH4)2CO3(s) NH4HCO3(s)+NH3(g) NH4HCO3(s)+NH3(g) |
D.MgCO3(s) MgO(s)+CO2(g) MgO(s)+CO2(g) |
科目:高中化学 来源:2013-2014广西桂林市、崇左市、防城港市、北海市高三化学试卷(解析版) 题型:简答题
(15分)W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数的变化如右图所示,已知W的一种同位素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻,N的单质是日常生活中常用的金属材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最强。

(1)W的另一种同位素的质子数与中子数相等,原子符号表示为 ;元素Y在周期表中的位置是 。
(2)下列有关物质性质的比较中,正确的是 (填字母编号)。
A.W、X、Y三种元素最简单氢化物的稳定性:W>Y>X
B.M、X、Z三种元素形成的单质熔点:X>M>Z
C.Y、Z两种元素的含氧酸酸性:Z>Y
D.Y、Z两种元素的单核阴离子还原性:Y>Z
(3)元素W与M按原子个数比1:l形成的化合物的电子式为 。
(4)元素X与Z形成的五原子分子的空间结构属于 形。
(5)与Z同族的元素都能与氢元素形成氢化物,其中水溶液酸性最弱的是 (填化学式)。
(6)含有N元素的两种离子在溶液中相遇能快速发生反应,写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应属于氧化还原反应的是 ( )
| A.CaCO3+2HCl===CaCl2+CO2↑+H2O | B.CO2+H2O===H2CO3 |
| C.2H2O2催化剂 2H2O+O2↑ | D.CaCO3 CaO+CO2↑ CaO+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列原子结构模型与科学家对应不正确的一项是:
| A.阿伏加德罗的原子学说 |
| B.汤姆生的“葡萄干面包式”原子结构模型 |
| C.卢瑟福的带核原子结构模型 |
| D.玻尔的核外电子在一定轨道上运动的观点 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(共14分)(Ⅰ)某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
 MnO2 MnO2时间 H2O2 | 0.1 g | 0.3 g | 0.8 g |
| 10 mL 1.5% | 223 s | 67 s | 56 s |
| 10 mL 3.0% | 308 s | 109 s | 98 s |
| 10 mL 4.5% | 395 s | 149 s | 116 s |
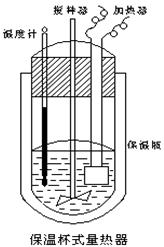
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
12分)某学生用0.1000mol/LKOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如
下几步:
A 移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
B 用标准溶液润洗滴定管2-3次
C 把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
E.调节液面至0或0刻度以下,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面刻度
(1) 正确操作的顺序是(用序号字母填写) B- 。
(2) 滴定开始后,眼睛注视 ,判断滴定终点的现象是:
(3) 下列操作中可能使所测盐酸的浓度数值偏高的是
A 碱式滴定管未用标准溶液润洗就直接注入标准液
B 滴定前盛放HCl的锥形瓶用蒸馏水洗净后有少量水残留
C 碱式滴定管在滴定前有气泡,滴定后气泡消失
D 读取氢氧化钠溶液时,开始仰视读数,滴定结束时俯视读数
(4)滴定开始和结束时,碱式滴定管中的液面如图C所示,则终点读数为 mL,所测盐酸溶液的浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.天然油脂的分子中含有酯基,属于酯类 |
| B.煤经处理变为气体燃料的过程属于物理变化 |
| C.A12O3可以与水反应得到其对应水化物 Al(OH)3 |
| D.可以用加热使蛋白质变性的方法分离提纯蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
废电池造成污染的问题日益受到关注,集中处理废电池的首要目的是
| A.回收石墨电极 |
| B.回收电池外壳的金属材料 |
| C.防止电池中渗泄的电解液腐蚀其他物品 |
| D.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
A、B、C、D、E、F为前四周期的元素。其中,A元素和B元素的原子都有一个未成对电子,A3+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解性在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4,其最高价氧化物对应的水化物可以用于制取炸药和制作铅蓄电池;E元素的基态原子核外有六种运动状态的电子;F元素的单质为紫红色固体,可通过“湿法冶金”而得。请回答下列问题:
(1)CB3分子中心原子的杂化类型是 。
(2)F元素的原子的外围电子排布式为 ;如图所示为F与Au以3∶1形成的合金晶胞图,在图中的括号内写出对应的元素符号。
(3)B、D元素最高价氧化物对应的水化物的酸性强弱: > (填化学式)。
(4)用导线将A和F的单质做成的电极连接起来,插入到盛有C的最高价氧化物的水化物的浓溶液中构成原电池,试写出在单质A表面发生反应的电极反应式:_____。
(5)分子R是由C元素与氢元素形成的18电子分子,R的电子式为 。
(6)24 g E的单质在33.6 L氧气(标准状况)中燃烧,至反应物全部耗尽,放出x kJ热量。则1mol E与O2反应生成E的低价氧化物时的热化学方程式为 (已知:E的燃烧热为y kJ/mol)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com