
【题目】CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品.
(1)CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2 , 在催化剂的作用下发生反应:CO(g)+Cl2(g)COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如下表:
t/min | n (CO)/mol | n (Cl2)/mol |
0 | 1.20 | 0.60 |
1 | 0.90 | |
2 | 0.80 | |
4 | 0.20 |
①反应0~2min末的平均速率v(COCl2)=mol/(Lmin).
②在2min~4min间,v(Cl2)正 v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=
③已知X、L可分别代表温度或压强,图1表示L一定时,CO的转化率随X的变化关系.
X代表的物理量是;a0 (填“>”,“=”,“<”).
(2)在催化剂作用下NO和CO转化为无毒气体,2CO(g)+2NO(g)2CO2(g)+N2(g)△H=﹣748kJmol﹣1
①一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图2所示.温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是 .
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法.其中CO传感器的工作原理如图3所示,则工作电极的反应式为;方法2:氧化还原滴定法.用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度.写出NO与H2O2溶液反应的离子方程式
(3)用CO和H2可以制备甲醇,反应为CO(g)+2H2(g)CH3OH(g),以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是
【答案】
(1)0.1;=;5;温度;<
(2)温度升高到710K时,单位时间内反应达平衡,该反应是放热反应,升高温度,平衡向左移动,转化率降低;CO﹣2e﹣+H2O═CO2+2H+;2NO+3H2O2═2NO3﹣+2H2O+2H+
(3)C(K+)>C(CO32﹣)>C(HCO3﹣)>C(OH﹣)>C(H+)
【解析】解:(1)①由表中数据,可知0~2min内△n(CO)=1.2mol﹣0.8mol=0.4mol,由方程式可知△c(COCl2)=△c(CO)=0.4mol,则v(COCl2)= ![]() =0.1mol/(L.min),
=0.1mol/(L.min),
所以答案是:0.1;
②4min内,反应的氯气为0.6mol﹣0.2mol=0.4mol,由方程式可知参加反应的CO为0.4mol,故4min时CO为1.2mol﹣0.4mol=0.8mol,与2min时CO的物质的量相等,则2min、4min处于平衡状态,在2min~4min间,v(Cl2)正=v(Cl2)逆 ,
由方程式可知,平衡时生成COCl2为0.4mol,该温度下平衡常数K= ![]() =
= ![]() =5,
=5,
所以答案是:=;5;
③正反应为气体体积减小的反应,增大压强平衡正向移动,CO转化率增大,而图中随X增大时,CO的平衡转化率降低,平衡逆向移动,则X为温度,正反应为放热反应,故a<0,
所以答案是:温度;<;
(2.)①当温度升高到710K时,单位时间内反应达平衡,由于该反应是放热反应,再升高温度,平衡向左移动,转化率降低,
所以答案是:温度升高到710K时,单位时间内反应达平衡,该反应是放热反应,升高温度,平衡向左移动,转化率降低;
②该装置是原电池,通入一氧化碳的电极是负极,负极上一氧化碳失电子发生氧化反应,电极反应式为:CO﹣2e﹣+H2O═CO2+2H+ , NO被H2O2溶液氧化成强酸硝酸,双氧水被还原成水,则反应的离子方程式2NO+3H2O2═2NO3﹣+2H2O+2H+ ,
所以答案是:CO﹣2e﹣+H2O═CO2+2H+;2NO+3H2O2═2NO3﹣+2H2O+2H+;
(3.)当有0.5mol甲醇参与反应时,产生的二氧化碳是0.5mol,和0.8mol氢氧化钾反应,根据元素守恒可以计算n (K2CO3)=0.3mol,n (KHCO3)=0.2mol,二者的水溶液均为碱性,所以C(K+)>C(CO32﹣)>C(HCO3﹣)>C(OH﹣)>C(H+),
所以答案是:C(K+)>C(CO32﹣)>C(HCO3﹣)>C(OH﹣)>C(H+).
【考点精析】解答此题的关键在于理解反应速率的定量表示方法的相关知识,掌握反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t,以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】我国自主研发的大飞机C919其主结构材料大量使用了铝锂合金,利用的是铝锂合金的( )
A.低密度、高强度B.高强度、导热性
C.低密度、导电性D.导热性、导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:归纳正确的是( )
①对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
②常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c(Na+)+c(H+)═c(OH﹣)+c(CH3COO﹣)
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④若将适量CO2 通入0.1molL﹣1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32ˉ)+c(HCO3ˉ)=0.1molL﹣1
⑤常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:KaKh=Kw .
A.①②④⑤
B.②④
C.②⑤
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+B(g) ![]() 2C(g),根据下表中的数据判断下列图象错误的是( )
2C(g),根据下表中的数据判断下列图象错误的是( )
| p1(Mpa) | p2(Mpa) |
400℃ | 99.6 | 99.7 |
500℃ | 96.9 | 97.8 |
A.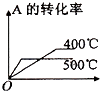
B.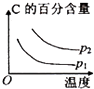
C.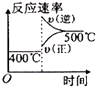
D.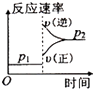
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学史上每一次重大的发现都极大地推进了科学的发展。俄国科学家门捷列夫对化学的突出贡献在于
A. 揭示了燃烧的本质B. 提出了元素周期律
C. 开发了合成氨的生产工艺D. 提取了治疟药物青蒿素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500mL的操作,请按要求填空:
(1)用量筒量取所需浓H2SO4的体积为
(2)如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好.量取时发现量筒不干净,用水洗净后直接量取,所配溶液浓度将(填偏高、偏低、无影响).
(3)将量取的浓H2SO4沿烧杯内壁慢慢注入盛有约100mL水的里,并不断搅拌,目的是
(4)将冷却后的上述溶液沿注入中,并用50mL蒸馏水洗涤烧杯次,洗涤液也要注入容量瓶中,并摇匀.如未冷却就转移,则所配溶液的浓度会(填偏高、偏低或无影响);若未洗涤烧杯,则所配溶液的浓度会(填偏高、偏低或无影响).
(5)加水至液面距刻度线下时,改用加水,使溶液的 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下将1molCO 和3mol 水蒸气放在密闭的容器中发生下列反应CO(g)+H2O(g)CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol 水蒸气,达到新的平衡后,CO2和H2的物质的量之和为( )
A.1.2 mol
B.1.5 mol
C.1.8 mol
D.2.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验所选择的装置或仪器正确的是( )
A | B | C | D | |
实 | 用CCl4提取溴水中的Br2 | 分离Fe(OH)胶体中的FeCl3溶液 | 从KI和I2的固体混合物中回收I2 | 配制100 mL 0.100 0 molL﹣1 KMnO4溶液 |
装置或仪器 |
|
|
|
|
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com