
| A. | △H=+244.1kJ/mol | B. | △H=-488.3kJ/mol | C. | △H=-996.6kJ/mol | D. | △H=+996.6kJ/mol |
分析 由盖斯定律可知,①×2+②×2-③得到2C(s)+2H2(g)+O2(g)=CH3COOH(l),以此计算反应热.
解答 解:①C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H2=-285.8kJ/mol
③CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
由盖斯定律可知,①×2+②×2-③得到2C(s)+2H2(g)+O2(g)=CH3COOH(l),
则2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热△H=(-393.5kJ/mol)×2+(-285.8kJ/mol)×2-(-870.3kJ/mol)=-488.3kJ/mol,
故选B.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、已知反应与目标反应的关系为解答的关键,侧重分析与应用能力的考查,注意盖斯定律的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
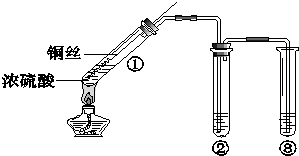 某小组同学探究浓硫酸及其部分反应产物的化学性质,装置如图所示(夹持装置略去).
某小组同学探究浓硫酸及其部分反应产物的化学性质,装置如图所示(夹持装置略去).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 密度/(g•cm-3) | 沸点/℃ | 水溶性 | |
| 1-丁醇 | 0.81 | 117.7 | 可溶 |
| 乙 酸 | 1.05 | 117.9 | 互溶 |
| 乙酸丁酯 | 0.88 | 126.3 | 微溶 |
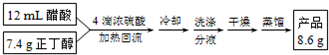
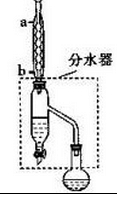
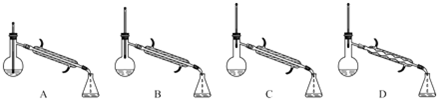
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
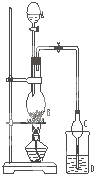 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质发生化学变化不一定伴随着能量变化 | |
| B. | 硫酸钡、醋酸铵、氨水都是弱电解质 | |
| C. | 向0.1 mol•L-1 Na2CO3溶液中滴加酚酞,溶液变红色 | |
| D. | 在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
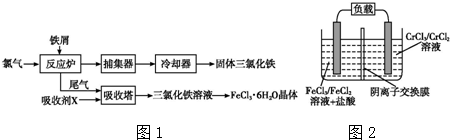
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥⑦ | B. | ①⑤ | C. | ②⑤⑦ | D. | ①③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com