
【题目】下图分别为生物体内生物大分子的部分结构模式图,据图回答下列问题。


丙
(1)图甲中的三种物质都是由许多__________连接而成的。这三种物质中,在功能上与另外两种截然不同的是__________,这种物质参与细胞中__________的构成。淀粉的水解产物可用___________试剂鉴定.
(2)图乙所示化合物的基本组成单位可用图中字母_________表示。
(3)图丙中化合物的含有肽键________个,含______种氨基酸,鉴定该化合物的试剂是____________,现象是________________
(4)图丙中化合物若要形成环状肽,可再发生化学反应的基团编号是_______。
【答案】葡萄糖 纤维素 细胞壁 斐林试剂 b 2 3 双缩脲试剂 溶液变紫色 ①⑥
【解析】
本题结合多糖、核苷酸链、肽链的结构图考查糖类的种类及功能、核酸分子结构特点、蛋白质合成--氨基酸脱水缩合,要求能准确判断图中各结构的名称,再结合所学的知识答题.
(1)淀粉、纤维素和糖原都是以葡萄糖为单体连接而成的多聚体。淀粉和糖原是储能物质,而纤维素参与构成细胞壁的组成。淀粉水解生成麦芽糖,麦芽糖具有还原性,可以用斐林试剂鉴定.
(2)图乙所示化合物RNA,RNA的基本组成单位是核糖核苷酸,可用图中字母b表示。
(3)-CO-NH-表示肽键,丙中含有2个肽键,R基有三种,所以有3种氨基酸,多肽与双缩脲试剂产生紫色反应。
(4)形成环状肽时由肽链一端的氨基和另一端的羧基脱水缩合,即图中的①⑥。


科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。已知:NH4HCO3![]() NH3↑+H2O+CO2↑。某学生设计了如下方案:
NH3↑+H2O+CO2↑。某学生设计了如下方案:

![]()
![]()
请回答下列问题:
(1)步骤①加热的目的是_____。
(2)写出步骤②中发生的离子方程式_____。
(3)步骤②,判断SO42-已除尽的方法是_______________________________________。
(4)步骤③的目的是_____,操作1用到的玻璃仪器有_____。
(5)操作2的名称是_____,应在_____(填仪器名称)中进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(H2C2O4)俗称草酸,是二元弱酸。回答下列问题:
(1)在恒温、恒容密闭容器中发生反应:H2C2O4(s)![]() H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是____________(填标号)。
H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是____________(填标号)。
A.压强不再变化 B.CO2(g)的体积分数保持不变
C.混合气体密度不再变化 D.混合气体平均摩尔质量保持不变
(2)草酸溶液中各离子浓度分数δ(X)随溶液pH变化的关系如图所示:

①当溶液中含碳粒子的主要存在形态为C2O42-时,溶液的酸碱性为____________(填标号)。
A.强酸性 B.弱酸性 C.中性 D.碱性
②25℃时,反应C2O42-+H2C2O4-![]() 2HC2O4-的平衡常数的对数值1gK=____________。
2HC2O4-的平衡常数的对数值1gK=____________。
(3)向10mL0.1mol·L-1H2C2O4溶液中逐滴加入0.1mol·L-1NaOH溶液,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,加入V(NaOH)____________10mL(填“>”“=”或“<”)。
(4)草酸晶体(H2C2O4·2H2O)为无色,某同学设计实验测定其纯度。实验过程如下:称取mg草酸晶体于试管中,加水完全溶解用cmol·L-1酸性KMnO4标准溶液进行滴定,则达到滴定终点时的现象是____________;该过程中发生反应的离子方程式为____________;滴定过程中消耗VmLKMnO4标准溶液,草酸晶体纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 无色透明的溶液中:Fe3+、Mg2+、SCN-、Cl-
B. c(Fe2+)=1mol·L-1的溶液中:K+、NH4+、MnO4-、SO42-
C. c(H+)/c(OH-)=1×10-12的溶液中:K+、Na+、CO32-、NO3-
D. 能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是( )
A.FeCl3=Fe2++3Cl﹣
B.NaOH=Na++OH﹣
C.H2SO4=H2++SO42﹣
D.NaHCO3=Na++H++CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是
A. Na2CO3 + CaCl2=CaCO3 ↓ + 2NaCl B. Cl2 + 2KI=2KCl + I2
C. 2NaHCO3 ![]() Na2CO3 + CO2 ↑ + H2O D. CaO + H2O=Ca(OH)2
Na2CO3 + CO2 ↑ + H2O D. CaO + H2O=Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下面的烃的名称或结构简式:
(1) _________________________________,
_________________________________,
(2)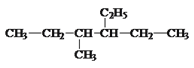 _______________________________,
_______________________________,
(3) __________________________________,
__________________________________,
(4)间甲基苯乙炔___________________________________,
(5)3-乙基-1-庚烯____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
(1)真空碳热还原![]() 氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
![]()
![]()
![]()
反应![]() 的
的![]() ___________
___________![]() 用含a、b的代数式表示
用含a、b的代数式表示![]() ;
;
(2)用活性炭还原法可以处理氮氧化物![]() 某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应
某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应![]()
![]() 在
在![]() 时,反应进行到不同时间测得各物质的浓度如下:
时,反应进行到不同时间测得各物质的浓度如下:

![]() 内,NO的平均反应速率
内,NO的平均反应速率![]() ________________,
________________,![]() 时,该反应的平衡常数
时,该反应的平衡常数![]() _______________;
_______________;
![]() 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ___________
后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ___________ ![]() 填字母编号
填字母编号![]() .
.
![]() 通入一定量的NO b.加入一定量的活性炭
通入一定量的NO b.加入一定量的活性炭
![]() 加入合适的催化剂
加入合适的催化剂 ![]() 适当缩小容器的体积
适当缩小容器的体积
![]() 若30min后升高温度至
若30min后升高温度至![]() ,达到平衡时,容器中NO、
,达到平衡时,容器中NO、![]() 、
、![]() 的浓度之比为3:1:1,则Q____________
的浓度之比为3:1:1,则Q____________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() .
.
![]() 在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 ___________
在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 ___________![]() 填选项编号
填选项编号![]() .
.
![]() 单位时间内生成
单位时间内生成![]() 的同时消耗
的同时消耗![]()
![]() 反应体系的温度不再发生改变
反应体系的温度不再发生改变
![]() 混合气体的密度不再发生改变
混合气体的密度不再发生改变
![]() 反应体系的压强不再发生改变
反应体系的压强不再发生改变
(3)铝电池性能优越,![]() 电池可用作水下动力电源,其原理如图所示:请写出该电池正极反应式_____________________________________________;常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mgAl,则电解后溶液的
电池可用作水下动力电源,其原理如图所示:请写出该电池正极反应式_____________________________________________;常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mgAl,则电解后溶液的![]() ___________
___________![]() 不考虑溶液体积的变化
不考虑溶液体积的变化![]() 。
。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com