
| A. | ①②③④⑤ | B. | ①③⑤④② | C. | ①⑤④③② | D. | ①②⑤③④ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
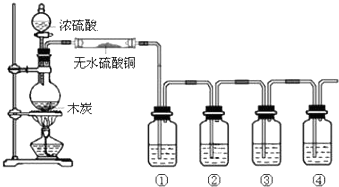
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
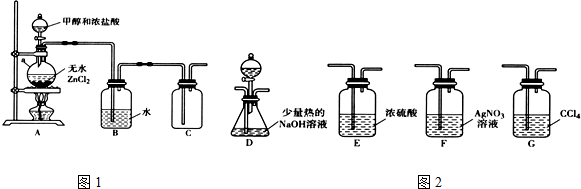
| 化学键 | C-Cl | C-Br |
| 键能(kJ•mol-1) | 330 | 276 |
| 化合物 | AgCl | AgBr |
| Ksp近似值 | 1.8×10-10 | 5×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
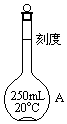 欲配制250mL0.1mol•L-1的H2SO4溶液,回答下列有关问题,有如下操作步骤:
欲配制250mL0.1mol•L-1的H2SO4溶液,回答下列有关问题,有如下操作步骤:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;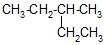 的系统命名为3-甲基戊烷;
的系统命名为3-甲基戊烷; ;
;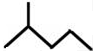 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
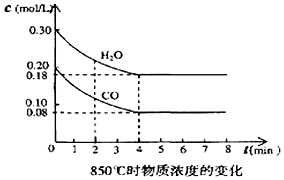 已知:O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1
已知:O2(g)+2H2(g)=2H2O(g)△H=-483.6kJ•mol-1| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何条件下,等物质的量O2的和CO所含的分子数必相等 | |
| B. | 0.012 kg 12C 含有约6.02×1023个碳原子 | |
| C. | 在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类 | |
| D. | CH4的摩尔质量为16g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com