
关于下列四个装置的说明符合实验要求的是
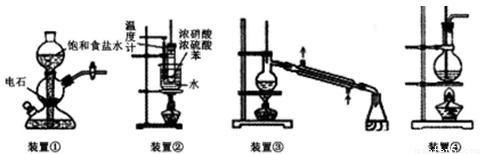
A.装置①:实验室中若需制备较多量的乙炔可用此装置
B.装置②:实验室中可用此装置来制备硝基苯,但产物中可能会混有苯磺酸
C.装置③:实验室中可用此装置来分离含碘的四氯化碳液体,最终在锥型瓶中可获得碘
D.装置④:实验室中可用此装置来制备乙酸乙酯并在烧瓶中获得产物
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年湖北省等高三下学期期中四校联考化学试卷(解析版) 题型:推断题
(B)(13分)根据以下转化关系(所有无机产物均已略去)。回答下列各问:
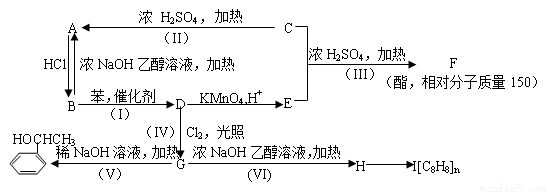
(1)在编号(I)~(VI)的六个反应中,属于取代反应的有(填反应编号) 。
(2)写出指定物质的结构简式:F ;I 。
(3)写出下列反应的化学方程式:
B转化为D的化学方程式: 。
G转化为H的化学方程式: 。
(4)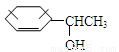 的同分异构体甚多,其中属于酚的同分异构体共有 种,这些同分异构体中,在核磁共振氢谱中有四个吸收峰的同分异构体的结构简式为: 。
的同分异构体甚多,其中属于酚的同分异构体共有 种,这些同分异构体中,在核磁共振氢谱中有四个吸收峰的同分异构体的结构简式为: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三综合能力测试(五)理综化学试卷(解析版) 题型:简答题
(15分)催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺。
(1)接触法制硫酸中采用V2O5作催化剂:
4FeS2(s)+11O2(g)=2Fe2O3(s) +8SO2(g) △H=―3412 kJ·mol-1
2SO2(g)+O2(g)  2SO3(g) △H=―196.6 kJ·mol-1
2SO3(g) △H=―196.6 kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H=―130.3 kJ·mol-1
以FeS2为原料,理论上生产2mol H2SO4(l)所释放出的热量为 kJ。
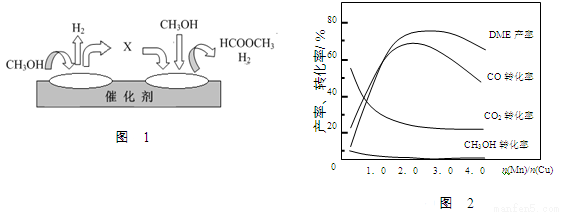
(2)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢、分解两步反应得到。
第一步:2CH3OH(g) HCOOCH3(g)+2H2(g) △H>0
HCOOCH3(g)+2H2(g) △H>0
第二步:HCOOCH3(g) CH3OH(g)+CO(g) △H>0
CH3OH(g)+CO(g) △H>0
①第一步反应的机理可以用图1所示。图中中间产物X的结构简式为 。
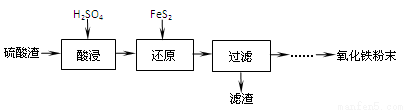
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化: ;
b.沉淀: ;
c.分离,洗涤;
d.烘干,研磨。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三二模考试理综化学试卷(解析版) 题型:选择题
对下列装置作用的分析或解释正确的是


A.装置甲可除去HCl中的Cl2杂质
B.装置乙可吸收SO2,并防止倒吸
C.装置丙石灰水变浑浊即可证明非金属性:Si>C
D.装置丁可制取并收集NO气体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三下学期三调考试化学试卷(解析版) 题型:简答题
选考[化学——物质结构与性质](15分)由Cu、N、B、Ni等元素组成的新型材料有着广泛用途。
(1)基态 Cu+的最外层核外电子排布式为_________.
(2)研究者预想合成一个纯粹由氮组成的新物种 N5+N3-,若N5+ 离子中每个氮原子均满足8电子结构,以下有关N5+ 推测正确的是 ( )
A.N5+有24个电子
B.N5+离子中存在三对未成键的电子对
C.N5+阳离子中存在两个氮氮三键
(3)化合物 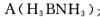 是一种潜在的储氢材料,它可由六元环状化合物
是一种潜在的储氢材料,它可由六元环状化合物 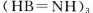 。通过
。通过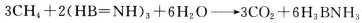 制得。
制得。
①与上述化学方程式有关的叙述不正确的是_________(填标号)。
A.反应前后碳原子的轨道杂化类型不变
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
C.第一电离能:N>O>C>B
D.化合物A中存在配位键
②1个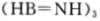 分子中有_________个
分子中有_________个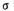 键。
键。
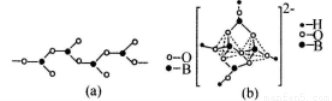
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为_________图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。
(5)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距离最近的两个阳离子核间的距离为_________(用含有a的代数式表示)。在一定温度下,Ni0晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为_________g(氧离子的半径为1. 40×10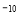 m,
m, 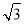 ≈l. 732)。
≈l. 732)。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三下学期三调考试化学试卷(解析版) 题型:选择题
某学生鉴定甲盐的流程如图所示,下列说法正确的是
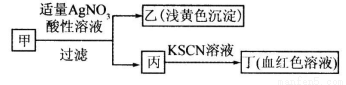
A.如果甲中含有S2-,则乙是硫磺沉淀
B.如果乙是AgCl沉淀,那么甲是FeCl3
C.丙中肯定含有Fe3+,所以甲是FeBr2
D.甲中含有铁元素,可能显示+2或者+3价
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高三下学期期中考试理综化学试卷(解析版) 题型:实验题
(14分)某化学小组用下图所列装置(固定装置略)验证CO能还原CuO,并探究其还原产物的组成。
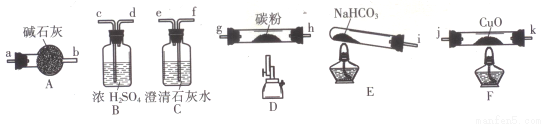
请回答:
(1)按气流方向,各装置从左到右的连接顺序为:
i→( )( )→( )( )→( )( )→( )( )→( )( )尾气处理(填仪器接口的字母编号)。
(2)说明CO能还原CuO的实验现象为___________________________。
(3)该实验处理尾气的方法为___________________________。
(4)若去掉B装置,可能产生的影响为___________________________。
(5)将各装置按正确的顺序连接后进行实验。当反应结束后,F处硬质玻璃管中的固体全部变为红色。
[查阅资料]Cu和Cu2O均为红色;Cu2O在酸性溶液中能生成Cu和Cu2+。
[提出猜想]红色固体的成分可能为:①Cu;②Cu2O;③________。
[实验验证]该小组为验证上述猜想,分别取少量红色固体放人试管中,进行如下实验。
实验编号 | 操作 | 现象 |
a | 加入足量稀硝酸,振荡 | 试管内红色固体完全溶解,溶液变为蓝色,并有无色气体产生 |
b | 加入足量稀硫酸,振荡 | 试管内有红色固体,溶液为无色 |
[实验评价]根据上述实验,不能确定红色固体成分的实验是________(填实验编号),理由为_________(用化学方程式表示)。
[实验结论]根据上述实验结果,可知红色固体的成分为________(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三4月阶段测试理综试卷化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.发展核电、煤中加入生石灰、利用二氧化碳制造全降解塑料都能有效减少环境污染
B.物质变化中炭化、钝化、皂化、酯化、熔化都属于化学变化
C.氢键、分子间作用力、离子键和共价键均为微粒间的相互作用力
D.农业废弃物、城市工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列溶液中的微粒浓度关系正确的是( )
|
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl﹣)+c(ClO﹣)+c(OH﹣) |
|
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3﹣)>c(CO32﹣)>c(H2CO3) |
|
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl﹣)=c(NH4+)>c(OH﹣)=c(H+) |
|
| D. | 0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(H+)﹣2c(OH﹣)=c(CH3COO﹣)﹣c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com