
 ,已知断裂1mol B-B吸收167kJ的热量,生成1mol B≡B放出942kJ热量.试写出由B4气态分子变成B2气态分子的热化学方程式:N4(g)═2N2(g)△H=-882 kJ/mol;
,已知断裂1mol B-B吸收167kJ的热量,生成1mol B≡B放出942kJ热量.试写出由B4气态分子变成B2气态分子的热化学方程式:N4(g)═2N2(g)△H=-882 kJ/mol;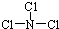 ,X与水反应的化学方程式是NCl3+3H2O═NH3+3HClO;
,X与水反应的化学方程式是NCl3+3H2O═NH3+3HClO;分析 A、B、C是中学化学中常见的三种短周期元素,①A元素原子最外层电子数是次外层电子数的2倍,元素最外层电子数不超过8,则其次外层是K层,则A是C元素;②B元素最高正价与最低负价的代数和为2,处于VA族,③C元素有多种化合价,且常温下C元素的单质与石灰水反应,可得到两种含C元素的化合物,考虑C为Cl,④B、C两种元素质子数之和是A元素质子数的4倍,则B为N元素,据此解答.
解答 解:A、B、C是中学化学中常见的三种短周期元素,①A元素原子最外层电子数是次外层电子数的2倍,元素最外层电子数不超过8,则其次外层是K层,则A是C元素;②B元素最高正价与最低负价的代数和为2,处于VA族,③C元素有多种化合价,且常温下C元素的单质与石灰水反应,可得到两种含C元素的化合物,考虑C为Cl,④B、C两种元素质子数之和是A元素质子数的4倍,则B为N元素.
(1)B为N元素,原子的电子排布式为1s22s22p3,故答案为:1s22s22p3;
(2)氯气与碱反应生成氯离子和次氯酸根离子和水,离子方程式为:Cl2+2OH-=ClO-+Cl-+H2O,故答案为:Cl2+2OH-═Cl-+ClO-+H2O;
(3)B为氮元素,断裂1molN-N吸收167kJ的热量,生成1molN≡N放出942kJ热量,则N4(g)═2N2(g)的△H=167×6kJ/mol-2×942kJ/mol=-882 kJ/mol,反应热化学方程式为:N4(g)═2N2(g)△H=-882 kJ/mol,
故答案为:N4(g)═2N2(g)△H=-882 kJ/mol;
(4)B为氮元素、C为氯元素,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构,则两种元素组成的化合物X为NCl3,结构中存在三个N-Cl共价单键,其结构式为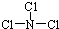 ,由X遇水蒸气可形成一种常见的漂白性物质,该漂白性物质为HClO,反应方程式为:NCl3+3H2O═NH3+3HClO,
,由X遇水蒸气可形成一种常见的漂白性物质,该漂白性物质为HClO,反应方程式为:NCl3+3H2O═NH3+3HClO,
故答案为: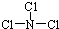 ;NCl3+3H2O═NH3+3HClO;
;NCl3+3H2O═NH3+3HClO;
(5)B2H4为N2H4,水溶液呈弱碱性是由于其与水中的氢离子结合,同时生成氢氧根离子的原因,即N2H4+H2O?H2N-NH3++OH-(或N2H5++OH-),故答案为:H2N-NH3++OH-(或N2H5++OH-).
点评 本题考查结构性质位置关系应用,推断元素是解题关键,是对所学知识的综合运用,难度中等.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案科目:高中化学 来源: 题型:选择题
| A. | SO3溶解于水时能导电,所以SO3是电解质 | |
| B. | 离子化合物中不存在独立的分子 | |
| C. | 稀硝酸能导电,所以HNO3溶液属于电解质 | |
| D. | 熔融时能导电的物质一定是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则b表示有催化剂的情况 | |
| B. | 若乙图中a曲线表示200℃、b曲线表示100℃时的情况,则反应的正反应是放热反应 | |
| C. | 若丙图中两条曲线分别表示不同压强下的情况,则b曲线是表示压强较大的情况 | |
| D. | 若丙图中两条曲线分别表示不同温度下的情况,则a曲线是表示温度较大的情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 12种 | C. | 16种 | D. | 18种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷是直链烃,但分子中碳原子不在一条直线上 | |
| B. | 在光照条件下,丙烷能够与氯气发生取代反应 | |
| C. | 丙烷比其同分异构体丁烷易汽化,耗氧量少 | |
| D. | 丙烷燃烧时主要是将化学能转变为热能和光能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.01mol•L-1•s-1 | B. | v(B)=0.02mol•L-1•s-1 | ||
| C. | v(B)=1.7mol•L-1•min-1 | D. | v(C)=1.0mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢,并采用新一代的氮化镓铟高亮度LED材料.下列有关说法正确的是( )
2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球“最强悍”工程.“鸟巢”运用了高强度、高性能的钒氮合金高新钢,并采用新一代的氮化镓铟高亮度LED材料.下列有关说法正确的是( )| A. | 合金的熔点通常比组分金属高,硬度比组分金属小 | |
| B. | 已知Ga处于ⅢA族,可推知氮化镓化学式为Ga3N2 | |
| C. | 用金属铝与V2O5冶炼钒,铝作还原剂 | |
| D. | 合金的化学性质一般与其各成分金属的化学性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X和Y一定是不同周期元素,但可能是同一主族元素 | |
| B. | 若X和Y都为金属,则X的金属性比Y强 | |
| C. | 若X、Y的简单离子分别是aXm+和bYn-,则有a+m=b-n | |
| D. | 若X和Y都为非金属,则它们的氢化物的稳定性X比Y强. |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述实验证明了氧化性:Fe3+>Fe2+>Cu2+ | |
| B. | 上述实验证明了Fe2+既有氧化性又有还原性 | |
| C. | 实验①中的化学反应是置换反应 | |
| D. | 向三个实验后的溶液中加入足量NaOH溶液振荡,最终都有Fe(OH)3生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com