
 能源、材料和信息是现代社会的三大“支柱”.
能源、材料和信息是现代社会的三大“支柱”. .d.HCHO,其中碳原子采取sp2杂化的分子有a、c、d(填字母).
.d.HCHO,其中碳原子采取sp2杂化的分子有a、c、d(填字母).分析 (1)①Ni原子在周期表中位于第4周期,VIII族,其价电子排布式为3d84s2;
②根据晶胞结构,对于立方晶胞,顶点粒子占$\frac{1}{8}$,面心粒子占$\frac{1}{2}$,棱上粒子占$\frac{1}{4}$,据此计算;
③根据有机物的空间构型判断其中C原子的杂化方式;
(2)①NH3沸点(-33.34℃)比N2O沸点(-88.49℃)高,二者同为分子晶体,考虑NH3分子间存在氢键,氢键作用力大于范德华力,使沸点异常升高;
②求等电子体通常采用的方法是上下左右平移元素,同时调电子数求得;
③根据VSEPR理论和杂化轨道理论判断NO3-空间构型.
解答 解:(1)①Ni原子在周期表中位于第4周期,VIII族,其价电子排布式为3d84s2,
故答案为:3d84s2;
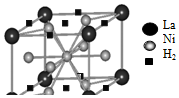
②根据晶胞结构,对于立方晶胞,顶点粒子占$\frac{1}{8}$,面心粒子占$\frac{1}{2}$,棱上粒子占$\frac{1}{4}$,则晶胞中含有的H2的数目为$8×\frac{1}{4}+2×\frac{1}{2}$=3,含有La的数目为$8×\frac{1}{8}$=1,则含1mol La的合金可吸附H2的数目为3×6.02×1023=1.806×1024,
故答案为:1.806×1024;
③根据有机物的空间构型判断其中C原子的杂化方式,
a.乙烯CH2=CH2 的空间结构为平面型,C的杂化方式为sp2,故a选;
b.乙炔HC≡CH 的空间构型为直线型,C的杂化方式为sp,故b不选;
c.苯 的空间构型为平面型,C的杂化方式为sp2,故c选;
的空间构型为平面型,C的杂化方式为sp2,故c选;
d.甲醛HCHO的空间构型为平面型,C的杂化方式为sp2,故d选;
故答案为:a、c、d;
(2)①NH3沸点(-33.34℃)比N2O沸点(-88.49℃)高,二者同为分子晶体,考虑NH3分子间存在氢键,氢键作用力大于范德华力,使沸点异常升高,其主要原因是:NH3分子间存在氢键,
故答案为:NH3分子间存在氢键;
②等电子体是指原子数目相同,价电子数目也相同的微粒,则与N2O互为等电子体的微粒有CNO-和N3-等,
故答案为:CNO-;N3-;
③对于NO3-,根据VSEPR理论和杂化轨道理论,中心N原子的配位原子数BP=3,孤电子对数为LP=$\frac{5-2×3+1}{2}$=0,则价电子对数为VP=BP+LP=3+0=3,根据杂化轨道理论,中心N原子的杂化方式为sp2,则空间构型呈平面三角形,
故答案为:平面三角.
点评 本题主要考察物质结构知识,包含价电子排布式的书写,晶胞的计算,杂化方式的判断,氢键的性质,价层电子对互斥理论判断分子空间构型,涉及的知识点均为高频考点,题目难度不大,是基础题.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:填空题
 .
. .A与水在催化剂存在下发生加成反应的化学方程式
.A与水在催化剂存在下发生加成反应的化学方程式 (只写主要产物).
(只写主要产物).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 项目 | 结论 |
| A | 三种有机化合物:乙烷、氯乙烯、苯 | 分子内所有原子均在同一平面上 |
| B | C(CH3)4的二氯代物数目(不考虑立体异构) | 2种 |
| C | 除去乙酸乙酯中残留的乙酸 | 可用氢氧化钠溶液 |
| D | 乙醇直接转化为乙酸,油脂水解 | 均属于取代反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是反应CO(g)+2H2(g)═CH3OH(g)进行过程中的能量变化曲线.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.下列相关说法正确的是( )
如图是反应CO(g)+2H2(g)═CH3OH(g)进行过程中的能量变化曲线.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.下列相关说法正确的是( )| A. | 该反应的△H=+91KJ/mol | |
| B. | 加入催化剂,该反应的△H变小 | |
| C. | 反应物的总能量比生成物的总能量高 | |
| D. | 如果该反应生成液态CH3OH,则△H变大. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 氢气 | 洗气 |
| C | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D | 溴苯(溴单质) | 蒸馏水 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ④⑤ | C. | ③⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 “一碳化学”的重要反应CO(g)+2H2(g)?CH3OH(g)的过程能量情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
“一碳化学”的重要反应CO(g)+2H2(g)?CH3OH(g)的过程能量情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )| A. | 曲线I的反应热比曲线II高 | |
| B. | 曲线I的反应速率比曲线II快 | |
| C. | 该反应的活化能为+91 kJ•mol-1 | |
| D. | 如果该反应生成液态CH3OH,则△H减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cs显+3价,I、Br均显-1价 | B. | Cs显+1价,Br显+1价,I显-1价 | ||
| C. | CsIBr2具有较强的氧化性 | D. | CsIBr2不能与氯水反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com