
| A. | ④③①⑤ | B. | ②③⑤① | C. | ④⑥③① | D. | ④⑤⑥③ |
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案科目:高中化学 来源: 题型:选择题

| A. | 自然界化合态硫主要以硫铁矿、黄铜矿、石膏、芒硝等形式存在 | |
| B. | 火法炼铜的矿石原料主要含CuS | |
| C. | 该公司炼铜产生的SO2可用于生产H2SO4 | |
| D. | 常温下,18.4 mol/L H2SO4溶液可储存于铁制或铝制容器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作和现象 | 实验结论 | |
| A | 分别向2mL 0.1mol•L-1 CH3COOH溶液和2mL 0.1mol•L-1H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性:CH3COOH>H2CO3>H3BO3 |
| B | 用3mL稀盐酸与过量Zn反应,当气泡稀少时,加入1mL 浓盐酸,又迅速产生较多气泡 | 盐酸浓度增大,反应速率加快 |
| C | 向少量无水乙醇中加入一小粒金属Na,生成可燃性气体 | CH3CH2OH是弱电解质 |
| D | 向2mL 0.1mol•L-1 NaOH溶液中滴加3滴0.1mol•L-1 MgCl2溶液,出现白色沉淀后,再滴加3滴0.1mol•L-1 FeCl3溶液,出现红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
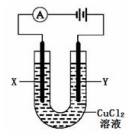
| A. | 电极X上发生氧化反应 | |
| B. | 电极Y上有气体产生 | |
| C. | 接通电路时,电子从电源的负极流出经过溶液后再从正极流 回电源 | |
| D. | 若反应中有0.1mol电子转移则阴极产物的质量为3.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
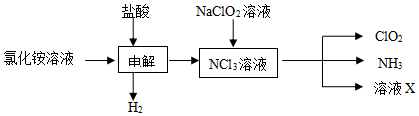
| 实验步骤 | 实验现象 | 实验结论 |
| I:取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 | 溶液X中含有钠离子 | |
| II:取少许溶液X于一支试管中,滴加先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液), | 溶液X中含有氯离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水华、赤潮等水体污染与大量排放硫、氮氧化物有关 | |
| B. | 淀粉可以作为阿司匹林、去痛片等药片的黏合材料 | |
| C. | 硅胶常用作袋装食品'瓶装药品的干燥剂 | |
| D. | 绿色化学的核心是利用化学原理从源头上减少和消除污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA | |
| B. | 常温下,6.4g由S2、S4、S8组成的混合物含硫原子数为0.2NA | |
| C. | 25℃时,0.lmol/LNa2CO3溶液含Na+数为0.2NA | |
| D. | 标准状况下,Na2O2与足量的CO2反应生成2.24LO2,转移电子为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
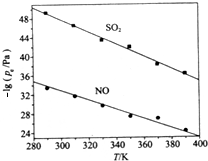 煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝.回答下列问题:
煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝.回答下列问题:| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com