
A.若两者恰好中和,混合后溶液pH一定等于7
B.若a+b=14,两者恰好中和,不能确定HA是否为强酸
C.若混合后溶液呈碱性,则溶液浓度c(NaOH)>c(HA)
D.无论两者是否完全中和,混合溶液中必有c(A-)+c(OH-)=C(Na+)+c(H+)
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
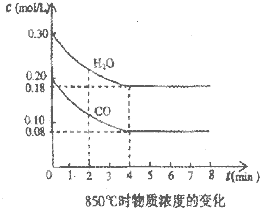 Ⅰ、(1)在25℃条件下将pH=3的醋酸稀释100倍后溶液的pH为
Ⅰ、(1)在25℃条件下将pH=3的醋酸稀释100倍后溶液的pH为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012届山东省济南外国语学校高三9月质量检测化学试卷 题型:填空题
(14分)根据下列化合物:① NaCl ② NaOH ③ HCl ④ NH4Cl ⑤ CH3COONa ⑥CH3COOH ⑦ NH3?H2O ⑧H2O
请回答下列问题:
(1)NH4Cl溶液显 性,用离子方程式表示 ,其溶液中离子浓度大小顺序为 ;
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)= ;在pH=3的CH3COOH 溶液中,水电离出来的c(H+)= ;
(3)已知水存在如下平衡:H2O+ H2O H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是 。
H3O++OH- △H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是 。
| A.向水中加入NaHSO4固体 | B.向水中加Na2CO3固体 |
| C.加热至100℃[其中c(H+) = 1×10-6 mol?L-1] | D.向水中加入 (NH4)2SO4固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com