��̼�������Ե��ܺġ�����Ⱦ�����ŷ�Ϊ�����ľ���ģʽ����̼ѭ������Ϊ��ѧ���о�����Ҫ���⣮
������п�ѧ��������룺�ѿ������뱥��̼�����Һ��Ȼ���ٰ�CO
2����Һ����ȡ����������ѧ��Ӧ��ʹ֮��Ϊ������ȼ�ϼ״����ù��뼼���������£�
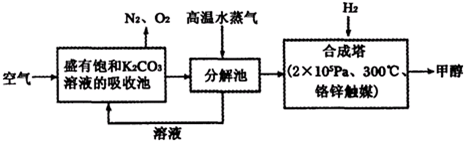
��1����ֽ����ͨ�����ˮ������������
��
��2����֪�ڳ��³�ѹ�£�
��2CH
3OH��l��+3O
2��g��=2CO
2��g��+4H
2O��g����H=-1275.6kJ/mol
��2CO��g��+O
2��g��=2CO
2��g����H=-566.0kJ/mol
��H
2O��g��=H
2O��1����H=-44.0kJ/mol
��״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ
��
��һ����̼������Ҳ���Ժϳɼ״�����ӦΪCO��g��+2H
2��g��?CH
3OH��g����H��0��
��1��ij�¶��£���2mol CO��6mol H
2����2L���ܱ������У���ַ�Ӧ�ﵽƽ�⣬���c��H
2��=2.2mol?L
-1����CO��ת����Ϊ
��
��2��T
1��ʱ���˷�Ӧ��ƽ�ⳣ��ΪK��T
1��=50�����¶��£���һ��2L���ܱ������м���һ����CO��H
2����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
| ���� |
H2 |
CO |
CH3OH |
| Ũ��/��mol?L-1�� |
0.2 |
0.2 |
0.4 |
�ٱȽϴ�ʱ�����淴Ӧ���ʵĴ�С��v
��
v
��ֵ�����������������=������
����������������ʱ��ֻ�ı䷴Ӧ��ijһ������������˵����ȷ����
��
A�����ﵽ��ƽ��ʱc��CO��=0.3mol/L��ƽ��һ�������ƶ�
B���������������С��ԭ����һ�룬�ﵽ��ƽ��ʱ��0.2mol/L��c��CO����0.4mol/L
C������������ͬʱ����0.4mol CO��0.8mol CH
3OH��g����ƽ�ⲻ�ƶ�
D���������¶ȣ�ƽ�ⳣ��������
��CO
2��SO
2�Ĵ����������ѧ�Ҷ��������о����ص㣮��ѧ��������ͼ��ʾװ����ȼ�ϵ��ԭ����CO
2��SO
2ת��Ϊ��Ҫ�Ļ���ԭ�ϣ�
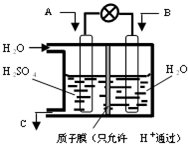
��1����AΪCO
2��BΪH
2��CΪCH
3OH������ܷ�ӦʽΪCO
2+3H
2=CH
3OH+H
2O����������ӦʽΪ
��
��2����AΪSO
2��BΪO
2��CΪH
2SO
4������ӦʽΪ
��





