
【题目】![]() 溶液与
溶液与![]() 锌粉在量热计中充分反应。测得反应前温度为
锌粉在量热计中充分反应。测得反应前温度为![]() ,反应后最高温度为
,反应后最高温度为![]() 。
。
已知:反应前后,溶液的比热容均近似为![]() 、溶液的密度均近似为
、溶液的密度均近似为![]() ,忽略溶液体积、质量变化和金属吸收的热量。请计算:
,忽略溶液体积、质量变化和金属吸收的热量。请计算:
(1)反应放出的热量![]() _____J。
_____J。
(2)反应![]() 的
的![]() ______
______![]() (列式计算)。
(列式计算)。
【答案】![]()
![]()
【解析】
(1)根据中和滴定实验的原理可知,该反应放出的热量可根据Q=cm![]() 计算;
计算;
(2)结合焓变的概念及其与化学计量数之间的关系列式计算。
(1)100mL 0.200mol/L CuSO4溶液与1.95g锌粉发生反应的化学方程式为:CuSO4+Zn=ZnSO4+Cu,忽略溶液体积、质量变化可知,溶液的质量m=![]() =1.00g/cm3×100mL(cm3)=100g,忽略金属吸收的热量可知,反应放出的热量Q=cm
=1.00g/cm3×100mL(cm3)=100g,忽略金属吸收的热量可知,反应放出的热量Q=cm![]() =4.18
=4.18![]() ×100g×(30.1-20.1)
×100g×(30.1-20.1)![]() = 4.18×103J,故答案为:4.18×103;
= 4.18×103J,故答案为:4.18×103;
(2)上述反应中硫酸铜的物质的量n(CuSO4)= 0.200mol/L×0.100L=0.020mol,锌粉的物质的量n(Zn)=![]() =0.030mol,由此可知,锌粉过量。根据题干与第(1)问可知,转化0.020mol硫酸铜所放出的热量为4.18×103J,又因为该反应中焓变
=0.030mol,由此可知,锌粉过量。根据题干与第(1)问可知,转化0.020mol硫酸铜所放出的热量为4.18×103J,又因为该反应中焓变![]() 代表反应1mol硫酸铜参加反应放出的热量,单位为kJ/mol,则可列出计算式为:
代表反应1mol硫酸铜参加反应放出的热量,单位为kJ/mol,则可列出计算式为:![]() ,故答案为:
,故答案为:![]() (答案符合要求且合理即可)。
(答案符合要求且合理即可)。


科目:高中化学 来源: 题型:
【题目】有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生。第二份加足量NaOH溶液加热后,收集到0.08mol气体。第三份加足量BaCl2溶液后,得到干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl-。__。
(2)由第二份进行的实验得知混合物中应含有__,其物质的量浓度为__。
(3)由第三份进行的实验可知12.54g沉淀的成分及物质的量是__。
(4)综合上述实验,你认为以下结论正确的是__。
A.该混合液中一定含有K+、NH4+![]() 、CO32-、SO42-,可能含Cl-,且n(K+)≥0.04mol
、CO32-、SO42-,可能含Cl-,且n(K+)≥0.04mol
B.该混合液中一定含有NH4+、CO32-、SO42-,可能含K+、Cl-
C.该混合液中一定含有NH4+、CO32-、SO42-,可能含Mg2+、K+、Cl-
D.该混合液中一定含有NH4+、SO42-,可能含Mg2+、K+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B. MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO (s)
MgO (s)
C. S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
D. N2(g)![]() NH3(g)
NH3(g)![]() Na2CO3(s)
Na2CO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e--=4OH--
C. 每转移0.1mol电子,消耗1.12L的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肯定属于同族元素且性质相似的是( )
A.原子核外电子排布式:A为1s22s2,B为1s2
B.结构示意图:A为![]() ,B为
,B为
C.A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上有1个未成对电子
D.A原子基态时3p轨道上有一对成对电子,B原子基态时4p轨道上也有一对成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.形成配位键后,离子的颜色、溶解性和某些化学性质会发生改变
B.配位数为4的配合单元一定呈正四面体结构,配位数为6的配合单元一定呈正八面体结构
C.配位化合物Ni(CO)4结构如图,1mol分子中所含的配位键个数有8NA
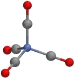
D.[Pt(NH3)6]2+和[PtCl4]2-中,其中心离子的化合价都是+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CdSnAs2是一种高迁移率的新型热电材料,回答下列问题:
(1)Sn为ⅣA族元素,单质Sn与干燥Cl2反应生成SnCl4。常温常压下SnCl4为无色液体,SnCl4空间构型为_____________,其固体的晶体类型为_____________。
(2)NH3、PH3、AsH3的沸点由高到低的顺序为_____________(填化学式,下同),还原性由强到弱的顺序为____________,键角由大到小的顺序为_____________。
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有_________mol,该螯合物中N的杂化方式有__________种。
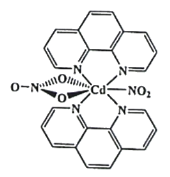
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
坐标 原子 | x | y | z |
Cd | 0 | 0 | 0 |
Sn | 0 | 0 | 0.5 |
As | 0.25 | 0.25 | 0.125 |
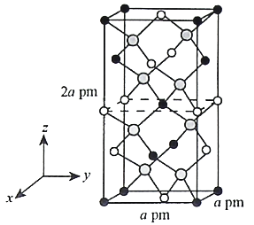
一个晶胞中有_________个Sn,找出距离Cd(0,0,0)最近的Sn_________(用分数坐标表示)。CdSnAs2
晶体中与单个Sn键合的As有___________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C60、金刚石和石墨的结构模型如图所示(石墨仅表示出其中的一层结构)。
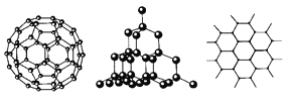
(1)C60、金刚石和石墨三者的关系互为________。
A.同分异构体 B.同素异形体
C.同系物 D.同位素
(2)固态时,C60属于________晶体(填“离子”、“原子”或“分子”),C60分子中含有双键的数目是________个。
(3)硅晶体的结构跟金刚石相似,1 mol硅晶体中含有硅硅单键的数目约是________NA个。二氧化硅的结构相当于在硅晶体结构中每个硅硅单键之间插入1个氧原子,二氧化硅的空间网状结构中,硅、氧原子形成的最小环上氧原子数目是________个。
(4)石墨层状结构中,平均每个正六边形占有的碳原子数是________个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com