

分析 (1)根据SO42-、Ca 2+、Mg2+等易转化为沉淀而被除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的溶液;
(2)根据固体在坩埚加热分解;
根据NH4+的检验方法:取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有NH4+;
NH4+和HCO3-都能与氢氧根离子反应;
(3)实验室制取二氧化碳的反应原理和条件;根据在浓氨水中加碱石灰或生石灰,因为氨水中存在下列平衡:NH3+H2O?NH3•H2O?NH4++OH-加入碱石灰或生石灰溶于水产生氢氧根离子平衡左移,同时放出大量的热促进氨水的挥发,制得氨气;
(4)根据实验的原理:先称取一定量的天然碱晶体并溶解得到水溶液,将碳酸根全部转换成二氧化碳,利用二氧化碳和澄清石灰水产生沉淀,通过沉淀的质量求出二氧化碳的物质的量、Na2CO3的物质的量和质量,最终求出Na2CO3的质量分数.
解答 解:(1)SO42-、Ca2+、Mg2+等分别与Ba(OH)2溶液、Na2CO3溶液、Ba(OH)2溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的Ba(OH)2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加Ba(OH)2溶液再加Na2CO3溶液,过滤,最后加入盐酸,故答案为:acdeb;
(2)灼烧固体碳酸氢钠制Na2CO3,在坩埚加热分解,取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有NH4+,NH4+和HCO3-都能与氢氧化钠反应:NH4++HCO3-+2OH-=NH3•H2O+CO32-+H2O;
故答案为:坩埚;取少量滤液A于试管中,加入足量NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,证明A中含有NH4+;NH4++HCO3-+2OH-=NH3•H2O+CO32-+H2O;
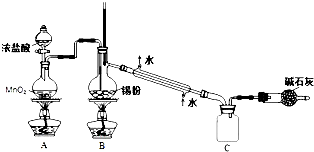
(3)实验室制取二氧化碳常选用石灰石和稀盐酸或大理石和稀盐酸反应制取,采用固体+液体$\stackrel{不加热}{→}$气体,故选BC;浓氨水中加碱石灰或生石灰,因为氨水中存在下列平衡:NH3+H2O?NH3•H2O?NH4++OH-,加入碱石灰或生石灰溶于水产生氢氧根离子平衡左移,同时放出大量的热促进氨水的挥发,制得氨气,所以分液漏斗中盛放的试剂是浓氨水,烧瓶内可加入的固体试剂是碱石灰或生石灰,故答案为:BC;浓氨水;碱石灰或生石灰;
(4)实验的原理:先称取样品质量并溶解,将碳酸根全部转换成二氧化碳,利用二氧化碳和澄清石灰水产生沉淀,通过沉淀的质量求出二氧化碳的物质的量、Na2CO3的物质的量和质量,最终求出Na2CO3的质量分数,所以将天然碱晶体样品,溶于适量蒸馏水中,加入足量稀硫酸并微热,产生的气体通过足量的澄清石灰水,然后过滤、洗涤、干燥、称量沉淀即可,
故答案为:用天平称取一定质量的晶体样品,加入足量稀硫酸并微热,产生的气体通过足量的澄清石灰水,过滤,洗涤,干燥,称量沉淀并计算.
点评 本题以制碱原理制取Na2CO3,涉及到物质的除杂和提纯,常见的实验操作,物质的制备等,难度中等,培养了学生运用知识的能力.


科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O
+H2O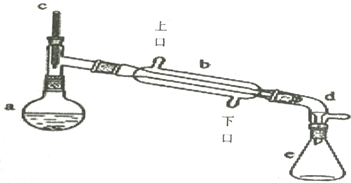
| 相对分子质量 | 密度/(g.cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都随温度的升高而增大 | |
| B. | 结构式为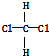 和 和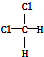 的物质互为同分异构体 的物质互为同分异构体 | |
| C. | 根据反应:NaA+CO2(少量)+H2O═HA+NaHCO3; 2NaB+CO2+H2O═2HB+Na2CO3,可以得出酸的强弱的顺序为:H2CO3>HA>HCO3->HB | |
| D. | 过硼酸钠晶体(NaBO3•4H2O)是一种优良的漂白剂,在70℃以上加热该晶体30.80克,反应后称量固体质量为27.20克,则该固体物质的化学式为NaBO3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 甲苯(
甲苯(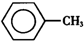 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(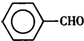 )、苯甲酸(
)、苯甲酸(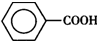 )等产品.下表列出了有关物质的部分物理性质,请回答:
)等产品.下表列出了有关物质的部分物理性质,请回答:| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度 (ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
 ,此反应的原子利用率理论上可达66.25%.【原子利用率=$\frac{期望产物的总质量}{全部反应物的总质量}$×100%】
,此反应的原子利用率理论上可达66.25%.【原子利用率=$\frac{期望产物的总质量}{全部反应物的总质量}$×100%】查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应在常温下均能自发进行 | |
| B. | 已知反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol,说明甲烷的燃烧热为802.3kJ/mol | |
| C. | 反应热的大小与反应物和生成物的键能无关 | |
| D. | 含1molNaOH的溶液分别和含0.5molH2SO4、1mol HNO3的溶液反应,放出的热量相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com