
| ���� | ��ʼ���� | ��ȫ���� |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Cr(OH)3 | 4.7 | a |
| Fe(OH)2 | 7.6 | 9.6 |
| Mg(OH)2 | 9.6 | 11.1 |
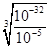 ��10��9 mol/L������ʱc(H��)��10��5 mol/L����pH��5ʱCr3��������ȫ��
��10��9 mol/L������ʱc(H��)��10��5 mol/L����pH��5ʱCr3��������ȫ��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������Һ��pHС��7 |
| B��c(CH3COOH)��c(CH3COO��)��0.20 mol��L��1 |
| C��c(CH3COOH)��c(CH3COO��) |
| D��c(CH3COO��)��c(OH��)��0.10 mol��L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| 0.01 mol��L��1 �������Һ | HF | CH3COOH | HCN | NH3��H2O |
| ����H����� ��OH����Ũ��/mol��L��1 | 8.00��10��4 | 1.32��10��4 | 1.00��10��4 | 1.33��10��4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������¶ȣ���Һ��pH���� |
| B��c(Na��)=2c(SO32�D)+c(HSO3-)+c(H2SO3) |
| C��c(Na��)+c(H��)=2c(SO32�D)+2c(HSO3-)+c(OH�D) |
| D����������NaOH���壬c(SO32�D)��c(Na��)������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ϡ������c(H+)��c(Cl��)��c(OH��) |
| B�������£���0��1mol/L���������Һ����ˮ�������c(OH��)��10-7mol/L |
| C�����Na2A��ˮ��Һ�����ԣ�����Һ��һ��û�е���ƽ�� |
| D����ˮ�м����������ܽ������ͣ���ʱ��Һ��pHС��7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��AlCl3��Һ��NaAlO2��Һ�ֱ���ȡ�������Ũ�����ᾧ������,���ù���ijɷ���ͬ |
| B������FeCl3��Һʱ,��FeCl3�����ܽ���������,Ȼ������ˮϡ�͵������Ũ�� |
| C���ü��ȵķ����ɳ�ȥKNO3��Һ�л��е�Fe3+ |
| D����ĭ������г�ʹ�õ�ԭ����̼���ƺ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����HNO2��Һ��������ʵ�飬�ƹ�ϰ���˵��HNO2��������� |
| B���ڵ��з�̪��Na2CO3��Һ����μ���BaCl2��Һ����ɫ����ȥ��˵��Na2CO3��Һ�д���ˮ��ƽ�� |
| C�������������pH������ʹ�����Һ�ֱ�ϡ����ͬ������������Һ��pH�仯�� |
| D�������ܽ��ԵIJ�ͬ�����þƾ�����ˮ�еĵ���ȡ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��c(OH��)��10��4 mol��L��1 |
| B����������NaOH���壬c(Na��)��c(HCO3��)������ |
| C��c(Na��)��c(H��)��c(HCO3��)��c(OH��) |
| D��c(Na��)��c(HCO3��)��c(CO32��)��c(H2CO3) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ��pH�仯�Ĺ�ϵ��
��pH�仯�Ĺ�ϵ�� | 91:9 | 1:1 | 9:91 |
| ������pH | 8.2 | 7.2 | 6.2 |
 = 1ʱ����ҺpH= 7.2��ԭ��___________________������0.20 mol/L ��NaOH��Һ����Ӧǰ����Һ������䣩����SO2������Ӧ����Һ�����ԣ���
= 1ʱ����ҺpH= 7.2��ԭ��___________________������0.20 mol/L ��NaOH��Һ����Ӧǰ����Һ������䣩����SO2������Ӧ����Һ�����ԣ����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com