
| m |
| M |
| 0.112L |
| 22.4L/mol |
| 1.74g |
| 58g/mol |
| 0.36g |
| 18g/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、H2SO3的酸性比HClO的酸性弱 |
| B、CH4、NH3、H2O、HF的热稳定性依次逐渐增强 |
| C、铍(Be)的原子失去电子能力比钙强 |
| D、硫、硒(Se)为同主族元素,非金属性Se比S弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它的元素符号为O |
| B、它的核外电子排布式为1s22s22p63s23p4 |
| C、可以与H2化合生成液态化合物 |
D、其原子轨道式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

| 足量K2CrO4溶液 |
| 过滤 |
| 过量HI |
| 稀HCl |
| Na2S2O3标液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
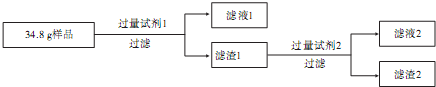
| 试剂1 | 试剂2 | 滤渣1质量 | 滤渣2质量 | |
| 实验一 | 稀盐酸 | NaOH溶液 | 12.4g | 6.4g |
| 实验二 | NaOH溶液 | 稀盐酸 | 28.8g | 6.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 编 号 | 猜 想 |
| 甲 | 溶液中的Fe3+又被还原为Fe2+ |
| 乙 | 溶液中的SCN-被过量的氯水氧化 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | | |
| | | |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )| A、元素X与元素Z的最高正化合价之和的数值等于8 |
| B、元素Y、W的气态氢化物的稳定性,前者比后者差 |
| C、元素W的最高价氧化物对应的水化物酸性比Q的强 |
| D、简单离子Y2-和Z3+的离子半径,后者比前者大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com