
| A. | 质子数是254 | B. | 质量数是102 | C. | 中子数是152 | D. | 电子数是254 |
科目:高中化学 来源: 题型:选择题
| A. | Fe | B. | Al | C. | Mg | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其中S原子轨道的杂化类型是sp3,它是极性(填“极性”或“非极性”)分子.
,其中S原子轨道的杂化类型是sp3,它是极性(填“极性”或“非极性”)分子.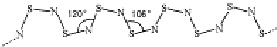
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 石灰石上滴加稀盐酸:CaCO3+2H+═Ca2++H2CO3 | |
| D. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
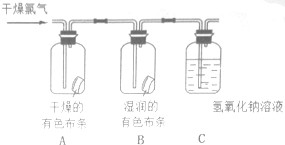 为了验证氯气的有关行政,某同学设计了如下的实验.
为了验证氯气的有关行政,某同学设计了如下的实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的结构示意图: | |
| B. | 乙酸的结构示意图:C2H4O2 | |
| C. | 硫酸的电离方程式:H2SO4═H2++SO42- | |
| D. | 氯化钠的电子式: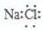 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
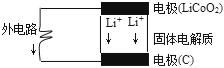 锂电池的构造如图所示,电池内部“→”表示放电时Li*的迁移方向,电池总反应可表示为:Li1-xCoO2+LixC$?_{放电}^{充电}$LiCoO2+6C,下列说法错误的是( )
锂电池的构造如图所示,电池内部“→”表示放电时Li*的迁移方向,电池总反应可表示为:Li1-xCoO2+LixC$?_{放电}^{充电}$LiCoO2+6C,下列说法错误的是( )| A. | 该电池的负极为LiCoO2 | |
| B. | 电池中的固体电解质可以是熔融的氯化钠、干冰等 | |
| C. | 充电时的阴极反应:Li1-xCoO2+xLi++xe-═LiCoO2 | |
| D. | 外电路上的“→”表示放电时的电子流向 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合c(Na+)+c(H+)=c(OH-)+c( HC2O4-) | |
| B. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) | |
| C. | NaHSO4溶液:c(H+)=c(SO42-)十c(OH-) | |
| D. | pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com