
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:| 号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
分析 (1)依据盖斯定律将已知的热化学方程式变形计算得到所需热化学方程式;
(2)①燃料电池正极通氧气,负极通燃料,故C为负极,D为正极,铜电极被氧化,发生的电极方程式为2Cu+2OH--2e-=Cu2O+H2O,故铜为阳极,与原电池的负极相连,即B与C,A与D相连;
②根据总反应,则阳极反应为2Cu-2e-+2OH-=Cu2O+H2O,所以离子交换膜应采用阴离子交换膜;在电解池的阳极发生失电子的氧化反应;
③据原电池中负极发生氧化反应来书写电极反应方程式;
(3)①催化剂效率越高,反应速率越快,到达平衡时间越短;
②平衡常数只受温度影响,温度不变,平衡常数不变,若温度升高,平衡向吸热方向移动,即向正反应方向移动,平衡常数增大,据此进行分析.
解答 解:(1)①2Cu(s)+$\frac{1}{2}$O2(g)═Cu2O(s)△H=-169KJ/mol,
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ/mol,
③Cu(s)+$\frac{1}{2}$O2(g)═CuO(s)△H=-157KJ/mol,
依据盖斯定律②+①-2×③得到C(s)+2CuO (s)=CuO(s)+CO(g)△H=+34.5kJ/mol,
故答案为:C(s)+2CuO (s)=CuO(s)+CO(g)△H=+34.5kJ/mol;
(2)①燃料电池正极通氧气,负极通燃料,故C为负极,D为正极,铜电极被氧化,发生的电极方程式为2Cu+2OH--2e-=Cu2O+H2O,故铜为阳极,与原电池的正极相连,即B与D,A与C相连,
故答案为:D;
②根据总反应,则阳极反应为2Cu-2e-+2OH-=Cu2O+H2O,所以离子交换膜应采用阴离子交换膜;在电解池的阳极发生失电子的氧化反应,故电极方程式为2Cu-2e-+2OH-=Cu2O+H2O,
故答案为:阴;2Cu-2e-+2OH-=Cu2O+H2O;
③原电池中负极发生氧化反应,故电极方程式为N2H4-4e-+4OH-=N2↑+4H2O,
故答案为:N2H4-4e-+4OH-=N2↑+4H2O;
(3)①实验①②相比,实验②到达平衡时间短,反应速率越快,催化剂效率高,
故答案为:<;
②实验1、2温度相同,平衡常数相同,即K1=K2,比较实验2、3,实验3中初始水蒸气浓度是实验2的一倍,但反应结束水蒸气浓度小于实验2的一倍,故平衡向正反应方向进行,则温度升高,平衡向吸热方向移动,该反应为吸热反应,所以平衡向正反应方向移动,平衡常数增大,即K3>K2,所以K1=K2<K3,
故答案为:K1=K2<K3.
点评 本题考查热化学方程式的书写,电极的判断以及电极反应方程式的书写,以及考查平衡常数只受温度影响,本题难度中等.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷和丙烯 | B. | 乙烷和2-丁烯 | ||
| C. | 甲烷和2-甲基丙烯 | D. | 乙烯和1-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 刚玉、红宝石主要成分是氧化铝,陶瓷,分子筛主要成分是有机物高分子化合物 | |
| B. | 石油原油的脱水,有色玻璃、纳米材料、塑料、橡胶及合成纤维等制造过程都会用到胶体 | |
| C. | 碳酸钙分解、氢氧化钡晶体和氯化铵固体反应、高温下铝与氧化铁反应都是吸热反应 | |
| D. | 风化、钝化、皂化、焰色反应都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64gCaC2中含有的共用电子对数为3NA | |
| B. | 标准状况下,11.2L己烷中含有的碳碳键数为2.5NA | |
| C. | 4.6gNO2在标准状况下,含有的分子数为0.1NA | |
| D. | 50mL12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3对饮用水进行杀菌、消毒 | |
| B. | 用电解氯化铝溶液的方法制取铝单质 | |
| C. | NH4F溶液储存于玻璃试剂瓶中 | |
| D. | 加热并蒸干硫酸铜溶液可得到硫酸铜固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用玻璃棒蘸取NaClO溶液点在干燥的PH试纸上,试纸呈现蓝色,证明HClO是弱酸 | |
| B. | 将一定量的FeCl3晶体、盐酸依次加入容量瓶中,配制一定物质的量浓度的FeCl3溶液 | |
| C. | 为证明Cu与浓硫酸反应生成了CuSO4,可将反应后的混合液冷却后再加入水,若显色即可证明生成了CuSO4 | |
| D. | 用乙醇、乙酸及浓硫酸制取乙酸乙酯的过程中发现忘加碎瓷片,需在完全冷却后再补 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,11.2LNO与5.6LO2混合后,所含分子数为0.5NA. | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含OH-数为0.1NA | |
| C. | 高温下,16.8g铁与足量水蒸气完全反应失去0.8NA个电子 | |
| D. | 0.1mol NaHSO4晶体中含阳离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
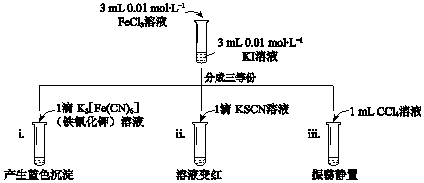
| A. | 实验i中现象说明有Fe2+生成 | |
| B. | 实验ii中现象说明反应后溶液中含有Fe3+ | |
| C. | 实验iii水溶液中c(Fe2+)大于i中c(Fe2+) | |
| D. | 实验iii中再加入4滴0.1 mol•L-1 FeCl2溶液,振荡静置,CCl4层溶液颜色无变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com