
| A、Na2CO3、NaHCO3两种盐的溶液中,离子种类是Na2CO3多于NaHCO3 |
| B、在CH3COONa溶液中c (CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| C、在0.1mol?L-1的醋酸溶液中加入适量的蒸馏水,溶液的c(H+)/c(CH3COOH)增大 |
| D、常温下,某溶液中由水电离出的c(H+)为10-5mol/L,则此溶液可能是盐酸 |


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
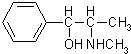 (1)药品分为处方药和非处方药.处方药是指必须在医生监控或指导下使用的药物,用符号
(1)药品分为处方药和非处方药.处方药是指必须在医生监控或指导下使用的药物,用符号查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3 |
| B、SiO2 |
| C、Na2SiO3 |
| D、CaSiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、21:5 | B、11:3 |
| C、3:1 | D、4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向水中加入NaHSO4溶液 |
| B、将水加热到100℃,使pH=6 |
| C、向水中加入Al2(SO4)3固体 |
| D、向水中加入CH3COONa固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、金属活动性A强于B |
| B、B的电极反应:B-2e-═B2+ |
| C、x电极上有H2产生,发生还原反应 |
| D、反应初期,x电极周围出现白色沉淀,不久后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲>乙>丙>丁 |
| B、丁<甲<乙=丙 |
| C、甲=丁<乙=丙 |
| D、丁<甲<乙<丙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com