
分析 ①酸雨与二氧化硫有关,向燃煤中加入石灰石,可大大减少该酸雨的发生,二氧化硫与CaO反应生成亚硫酸钙,再被氧化生成硫酸钙;
②合金的熔点比其各成分低;
③棉花为天然高分子化合物,光导纤维的成分为二氧化硅,只有聚苯乙烯为加聚反应生成的高分子.
解答 解:①酸雨与二氧化硫有关,向燃煤中加入石灰石,可大大减少该酸雨的发生,二氧化硫与CaO反应生成亚硫酸钙,再被氧化生成硫酸钙,硫酸型酸雨是由空气中的SO2含量过高引起,向燃煤中加入石灰石,可大大减少该酸雨的发生,最终可将煤中的硫转化为CaSO4,
故答案为:SO2;CaSO4;
②钠钾合金在常温下呈液态,Na、K常温为固体,可知合金的熔点比其各成分低,故答案为:b;
③棉花为天然高分子化合物,光导纤维的成分为二氧化硅,只有聚苯乙烯为加聚反应生成的高分子,则属于合成有机高分子材料的是a,故答案为:a.
点评 本题考查物质性质及应用,为高频考点,把握物质的性质、组成及反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L NH3溶于水后溶液中含有NA个NH4+ | |
| B. | 1L 0.1 mol•L-1的Na2CO3溶液中含有0.2 NA个Na+ | |
| C. | 1 mol 硫酸钾中阴离子所带电荷数为NA | |
| D. | 将0.1mol氯化铁溶于1L水中,所得溶液中含有0.1NAFe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、W 元素的离子半径依次减小 | |
| B. | W 的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| C. | 若W 与Y的原子序数相差5,则二者形成的化合物的化学式可能为Y2W3或Y3W2 | |
| D. | W 与X形成的化合物只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | R原子最外层电子数为5 | B. | 单质的氧化性:甲<乙 | ||
| C. | 原子半径:R>Z | D. | HRO3与HZ计量数之比为1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
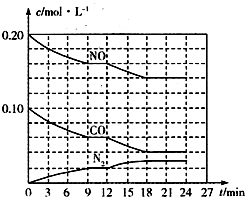 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(X)>r(Y)>r(Z) | |
| B. | 气态氢化物的热稳定性:X>Y | |
| C. | 元素X的最高价氧化物对应的水化物是强酸 | |
| D. | 化合物XY、Z2Y、Z2Y2中化学键的类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁粉与足量Cl2反应,失去的电子数为0.2NA | |
| B. | 1 mol NH3含有的电子数10NA | |
| C. | 常温常压下,22.4 L的氧气含氧原子数为2NA | |
| D. | 常温下,1 L0.1 mol•L-1AlCl3溶液中含Al3+数为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com