
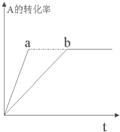
 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )| A. | 增大A的浓度 | B. | 扩大容器的容积 | C. | 加入催化剂 | D. | 升高温度 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g铁由原子变成离子时,失去的电子数一定为0.2NA | |
| B. | 0.2NA个硫酸分子与19.6g磷酸含有相同的氧原子数 | |
| C. | 28g氮气所含的原子数为NA | |
| D. | NA个氧分子与NA个氢分子的质量比为8:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液:①0.1mol/L HA溶液;②0.1mol/L HB溶液,分别与0.1mol/L NaOH溶液等体积混合后溶液中,c(H+):①<② | |
| B. | 等物质的量浓度的HA溶液与NaB溶液等体积的混合液:2c(Na+)═(A-)+c(B-)+c(HA)+c(HB) | |
| C. | pH=9的三种溶液①NaB;②NH3•H2O;③NaOH,由水电离出的c(OH-):①>②>③ | |
| D. | 物质的量浓度相等的NaA与NaB两溶液中:c(B-)>c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶内有水,未经过干燥处理 | |
| B. | 定容时,仰视刻度线 | |
| C. | 用量筒量取浓盐酸时,用水洗涤量筒2~3次,洗液倒入烧杯中 | |
| D. | 定容后倒转容量瓶几次,发现液体最低点低于刻度线,再补加几滴水到刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com